USO DE VASOPRESSOR EM ACESSO VENOSO PEIFÉRICO
EVIDÊNCIAS E RECOMENDAÇÕES ATUAIS
Dr. Alejandro Enrique Barba Rodas. Médico Responsável Técnico e Coordenador da Unidade Coronariana da Santa Casa de São Jose dos Campos. Coordenador da Residência em Medicina Intensiva – COREME e membro do Grupo Técnico de Enfrentamento à COVID -19 da Santa Casa de São Jose dos Campos.
O uso de drogas vasopressoras
através de acesso venoso superficial (funcionalmente denominado de “periférico”
- CVP (veja-se as considerações a respeito das denominações de “periférico” e “central”
feitas em post anterior que pode ser acessado aqui: http://blogdeterapiaintensiva.blogspot.com/)
tem sido objeto não apenas de debate, mas também de estudos ao longo dos anos.
Tradicionalmente a infusão
de drogas vasopressoras sempre foi feito por acesso venoso profundo e calibroso,
usualmente referido como “central” (CVC). As razões para isso sempre foram as
preocupações de que os vasopressores administrados através de um cateter venoso
periférico (CVP) podem causar flebite ou ainda isquemia e necrose do tecido
subcutâneo nos locais próximos da punção e em casos de extravasamento, conforme
relatos de casos apresentados. A fisiopatologia envolve a concentração
relativamente alta de norepinefrina tanto na veia receptora quanto nos vasos
sanguíneos adjacentes, levando à vasoconstrição e aumento da permeabilidade
vascular[1] [2] [3] [4] [5].
Fig.
1 Lesão tecidual por noradrenalina
Fig.
2 Lesão tecidual por dopamina
Entretanto, a inserção de
um cateter venoso central (CVC) leva algum tempo quando realizada de maneira
correta, e ainda está associada a complicações potencialmente perigosas para o
paciente (acidentes de punção, trombose, infecções associadas, etc.) pelo que o
uso do cateter venoso periférico (CVP) sempre foi considerado uma alternativa de
urgência pela sua praticidade na passagem e principalmente pelo fornecimento de
uma via rápida para administrar medicações vasopressoras num paciente
hemodinamicamente instável e com risco de vida. Um estudo recente examinando
CVCs em adultos descobriu que até 2,1% dos pacientes apresentaram complicações
mecânicas significativas, como pneumotórax que requer intervenção, 0,5-1,4%
apresentaram trombose venosa profunda sintomática diretamente atribuível ao
CVC, e outros 0,5-1,4% apresentaram infecção da corrente sanguínea[6].
Portanto, a discussão tem
sido dirigida a analisar o uso do CVP sob o aspecto de risco versus benefício,
considerando:
1. Quais seriam as indicações
para uso de vasopressores através de CVP?
2. Qual seria a técnica
mais segura para inserção?
3. Qual seria o dispositivo,
mas seguro para inserção?
4. Quais seriam os requisitos
para minimizar os riscos de complicações pelo extravasamento?
5. Por quanto tempo usar?
Farei uma revisão atualizada, tomando como base outras já publicadas em diferentes sites internacionais[7] [8] [9] [10] [11] [12] [13] [14].
ESTUDO 1
Em 2013, Ricard JD et.
al.
publicaram um ensaio clínico randomizado, multicêntrico, controlado, de grupo
paralelo e aberto, investigando a taxa de complicações associadas tanto à inserção
de cateter quanto à sua manutenção, usando cateteres venosos centrais (CVC) e cateteres
venosos periféricos (CVP). Para tanto, foram randomizados 263 pacientes em 3
UTIs francesas, para receber CVCs (135 pacientes) ou CVPs (128 pacientes) como
acesso venoso inicial. O desfecho primário foi a taxa de complicações maiores
relacionadas ao cateter em 28 dias. Os autores definiram para cada grupo o que
seriam complicações maiores e menores (mecânicas, infecciosas e trombóticas). Eles
encontraram significativamente mais complicações maiores relacionadas a CVP por
paciente quando tratados apenas com CVP em comparação com pacientes que
receberam pelo menos um CVC (133 vs 87, respectivamente, p = 0,02), embora
nenhuma delas representasse risco de vida. Complicações menores relacionadas ao
cateter foram maiores nos pacientes com cateter venoso central: 201 versus 248 (p
= 0,06). 46% (60/128) dos pacientes foram tratados durante sua permanência na
UTI apenas com cateteres venosos periféricos. Houve significativamente mais
complicações relacionadas ao CVP por paciente quando tratados exclusivamente
com CVP do que em pacientes que receberam CVP e pelo menos um CVC: 1,92
(121/63) versus 1,13 (226/200), p <0,005. Não houve diferença nas
complicações relacionadas ao CVC por paciente entre os pacientes inicialmente
randomizados para CVP, mas posteriormente cruzados para CVC e pacientes
randomizados para o grupo de CVC. As estimativas de probabilidade de
sobrevivência de Kaplan-Meier não diferiram entre os dois grupos. Concluíram os
autores que, em pacientes de UTI com igual necessidade de acesso venoso central
ou periférico, CVC devem ser inseridos preferencialmente visando usar uma
estratégia associada a menos complicações maiores[15]. No
entanto, um exame mais atento dos dados é muito mais tranquilizador. 56 das
“complicações” no grupo CVP foram simplesmente pacientes onde tiveram
dificuldade para colocar um acesso intravenoso. Não foram complicações de
relevância, na verdade. Alguns dos dados são difíceis de analisar, porque
relatam a intenção de tratar. Por exemplo, há 3 casos de pneumotórax no grupo CVP,
o que não é uma complicação comum desse procedimento. Para a complicação que
mais interessa, houve 22 eventos de extravasamento (17%) no grupo CVP e 2 (1%)
no grupo de CVC. Os autores não relatam o tipo de dano ao tecido no artigo, mas
informação posterior revela que não houve lesões teciduais significativas entre
os pacientes com extravasamento. Portanto, é evidente que ocorrerão
extravasamentos, mas o resultado da lesão do tecido orientado para o paciente é
muito raro[16].
ESTUDO 2
Em 2015, Cardenas-Garcia
et. al. publicaram um estudo observacional prospectivo (setembro
de 2012 a junho de 2014) de pacientes adultos recebendo medicações vasopressoras
(norepinefrina, dopamina e fenilefrina) por via intravenosa periférica durante
um período de 20 meses em uma UTI de centro único (Long Island Jewish Medical
Center – NY – USA). Eles incluíram um total de 734 pacientes com os vasopressores,
noradrenalina (506), dobutamina (101) e fenilefrina (176) administradas apenas
por CVP. A duração média da infusão foi de 49 +/- 22 horas, com a dose
mais alta de 0,70 ± 0,23 mcg/kg/min. Embora a posição anatômica do local de
acesso não tenha sido registrada formalmente, a maioria dos cateteres foram
passados na veia basílica ou cefálica do braço. Eles encontraram extravasamento
em apenas 19 (2%) casos. Nenhum desses pacientes teve qualquer lesão tecidual
local, mas todos foram tratados com fentolamina e pasta de nitroglicerina.
Os autores usaram um
protocolo rígido de passagem de CVP, que incluía uma série de requisitos para a
seleção da veia a ser puncionada, técnica de punção e tempo máximo de uso do CVP
(TABELA 1):
1. Diâmetro da veia >
4 mm medido com ultrassonografia (veja-se a técnica de avalição e punção em
post aqui publicado: http://blogdeterapiaintensiva.blogspot.com/)
2. Posição do CVP dentro
da veia, documentado pela ultrassonografia antes de começar a infusão do
vasopressor.
3. Uso apenas de veias da
extremidade superior, contralateral ao manguito de pressão arterial.
4. Cateter de calibre 18
ou 20G.
5. Não usar veias da mão,
pulso ou fossa ante cubital.
6. Verificar retorno de
sangue do acesso venoso periférico antes da administração de vasopressor.
7. Avaliação do acesso venoso
periférico a cada 2 horas de acordo com o protocolo de enfermagem.
8. Alerta imediata pela
equipe de enfermagem à equipe médica em caso de extravasamento, com pronto
início de tratamento local.
9. Duração máxima de 72
horas de uso do acesso venoso periférico.
Os autores concluem que o uso de vasopressor pode não ser uma indicação automática para a inserção do cateter venoso central. A administração de vasopressores como norepinefrina, dopamina, ou fenilefrina por acesso intravenoso periférico é viável, seguro e com baixo risco, mesmo usado por vários dias, se as precauções adequadas forem tomadas; e que o extravasamento era incomum. Fentolamina com pasta de nitroglicerina foram eficazes na prevenção de lesão isquêmica local[17].
ESTUDO 3
Em 2015, Loubani et. al. publicaram
uma revisão sistemática de pacientes adultos que receberam vasopressores
perifericamente e procuraram casos de necrose tecidual ou isquemia de membro
após extravasamento. Usaram o banco de dados do Medline, Embase e Cochrane
desde o início até janeiro de 2014 buscando dados em adultos que receberam
vasopressor por meio de CVP ou CVC. Não foi feita metanálise e análise de viés devido
à grande heterogeneidade de dados. Definiram “lesão local do tecido” como o evento
adverso atribuído à administração de vasopressor ocorrendo nas proximidades do
local de punção, “extravasamento de vasopressor” como escape da solução
contendo vasopressor do vaso através do qual é infundido no tecido circundante
ou cavidade corporal; e “incapacidade grave” o paciente incapaz de retornar ao
nível anterior de função devido a déficits graves do evento. Encontraram 85
artigos com 270 pacientes e 325 eventos separados de lesão tecidual local e
extravasamento incluídos (318 associados a CVP e 7 a CVC). Dos 318 eventos
associados a CVP, 204 foram eventos de lesão tecidual local e 114 eventos de
extravasamento. Dos 204 casos de lesão tecidual local (179 necrose de pele, 5
necrose de tecido e 20 de gangrena), 85,3% ocorreram em CVP localizados em locais
distais às fossas antecubital e poplítea e 96,8% ocorreram após 4 horas de
infusão pelo CVP. Apenas em um evento relatado ocorreu lesão tecidual local
com <1 hora, que foi um caso de choque séptico e infusão de fenilefrina em
dose não especificada pela veia safena da perna esquerda (Fig.3). Incapacidade
grave e mortalidade ocorreu em 9(4,4%) e 4(2,2%) casos, respectivamente. Dos 114
eventos de extravasamento, 75,4% não resultou em qualquer lesão tecidual e 75%
foram distais às fossas antecubital e poplítea. Incapacidade grave ocorreu em 3
casos (2,7%) e mortalidade em 1 caso (0,9%). Dos 7 eventos associados a CVC, 4
eventos foram de lesão de tecido local (3 necrose de pele e 1 gangrena) com sequelas
de longo prazo ocorrendo em 3 casos e deficiência menor em 2 casos; e mortalidade
em 1 caso. Dos 3 eventos de extravasamento, nenhuma ulcera foi relatada.
Concluem os autores que os medicamentos vasopressores são vasoconstritores
fortes que podem causar hipoperfusão e lesão tecidual. Salientam, entretanto, que
em razão das conclusões terem sido obtidas principalmente a partir de relatos de
casos, podem não ser representativos da prática verdadeira. Sugerem que em
situações de emergência, administração de curto prazo (< 2 horas) de infusões
de vasopressores via acessos venosos periféricos proximais e bem posicionados
são improváveis de causar lesão local do tecido, pelo que seu uso pode ser
feito até que o acesso venoso central seja obtido. Finalmente e afirmam que mais
pesquisas são necessárias para esclarecer o impacto e resultados clínicos da
administração periférica endovenosa de vasopressores em pacientes críticos hemodinamicamente
estáveis[18].
Fig.
3 Número de eventos em relação ao tempo de
Esta revisão foi apenas
para complicações da administração de vasopressor, e não uma revisão da frequência
de complicações (ou seja, casos em que não ocorreram complicações) Esta foi uma
revisão sistemática, mas muitas informações foram de gráficos, o que pode erar viés
de relato (ou seja, algumas complicações podem não ter sido documentadas) que
subestimariam as complicações. Houve uma grande inconsistência de relatórios
entre os estudos publicados revisados. Informações críticas para analisar os
resultados de interesse estavam faltando em muitos relatórios publicados. Desta
forma, em pacientes criticamente enfermos, com instabilidade hemodinâmica, a
infusão de vasopressor através de um CV proximal (fossa antecubital ou veia
jugular externa), por < 4 horas de duração, provavelmente não resultará em
lesão do tecido e reduzirá o tempo necessário para atingir a estabilidade
hemodinâmica[19]
[20].
ESTUDO 4
Em 2018, Medlej et. al. publicaram
um estudo prospectivo, observacional, unicêntrico, não randomizado, visando
determinar como desfecho primário, a incidência de complicações maiores (necrose
do tecido e isquemia do membro) associadas à utilização de vasopressores por
meio de CVP em pacientes com choque circulatório. Como complicações menores
avaliaram o extravasamento de drogas, tromboflebite e celulite localizada. Incluíram
pacientes que se apresentaram no pronto-socorro com choque circulatório nos
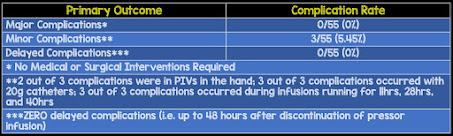
quais foi iniciada terapia vasopressora por meio de um CVP. 55 pacientes foram incluídos
com choque séptico (83,6%), cardiogênico (10,9%) e hipovolêmico/hemorrágico (5,5%).
Dos vasopressores, foram usados norepinefrina (90,9%) e dopamina (9,1%). Das veias
selecionadas, veia jugular externa (3,6%), do braço (1,8%), fossa antecubital (40%),
antebraço (18,2%) e mão (36,4%). Foram usados cateteres número 16 (10,9%), 18 (36,4%),
20 (50,9%) e 22 (1,8%) gauges. A duração média da infusão de vasopressor foi
de 14 horas para norepinefrina ou dopamina (faixa 7 - 40), 13 horas para norepinefrina
(faixa 6,5 - 31,5) e 53 horas para dopamina (faixa 15,5 - 113). Os CVPs
foram examinados visualmente 2x /dia durante a infusão do vasopressor e, em
seguida, diariamente até 48 horas após a descontinuação do vasopressor.
Fig. 4 Complicações ocorridas
As 3 complicações maiores que ocorreram, foram em pacientes com cateteres 20G, mas devido ao pequeno número de complicações é difícil concluir que cateteres de 20G não devem ser usados (Fg.4). O paciente 1 teve tromboflebite local, com norepinefrina (8mg em 250mL de G5%) por cateter de 20G na mão direita, infundida por 40 horas com taxa máxima de infusão de 7ug/min. O paciente 2 teve palidez cutânea, com norepinefrina (8mg em 250mL G5%) por cateter de 20G na mão esquerda, infundida por 11 horas com taxa máxima de infusão de 7ug/min. O paciente 3 teve eritema cutâneo não esbranquiçado, com norepinefrina (8mg em 250mL de G%) por cateter de 20G na fossa antecubital, infundida por 28 horas com taxa máxima de infusão de 19ug/min. Os autores concluem que “a incidência de complicações da administração de vasopressores através de CVP é pequena e não resultou em morbidade significativa no estudo[21].
ESTUDO 5
Em 2019, Pancaro et. al.
publicaram um estudo multicêntrico de coorte retrospectiva de um banco de dados
eletrônico perioperatório dos hospitais universitários de Amsterdã e Utrecht,
na Holanda. Estimaram a taxa de ocorrência de efeitos adversos relacionados ao
medicamento (ou seja, necrose de pele que requer tratamento cirúrgico) na
ocorrência de extravasamento periférico de norepinefrina diluída, uma concentração
bastante baixa (20ug/mL) por CVP em pacientes submetidos à cirurgia eletiva sob
anestesia geral. As infusões padrão de norepinefrina periférica usadas neste
estudo foram preparadas em SF 0.9% de modo que a diluição final foi 20 ug/mL
(dose de infusão inicial de 0,01 - 0,02ug/kg/min e titulada de acordo com a PA
desejada). O desfecho primário foi o evento adverso de medicamento associado à
administração periférica de norepinefrina (ou seja, extravasamento associado a
lesão de tecido que requer intervenção médica ou cirúrgica).14.385 pacientes
receberam norepinefrina por meio de uma infusão contínua periférica. Extravasamento
de drogas foi observado em 5 pacientes: 5/14.385 = 0,035% (IC 95% 0,011% -
0,081%); 1 - 8 eventos/10.000 pacientes. Zero complicações precisaram
intervenção cirúrgica ou médica (IC 95% 0% - 0,021%); 0 -2 eventos / 10.000
pacientes. Dos 5 eventos de extravasamento, a faixa de dosagem de
noradrenalina foi de 0,02 - 0,05ug/kg/min; o tempo de infusão médio total foi de
20 min (intervalo de 20 - 25 min), a dose média de norepinefrina administrada foi
de 40 ug (intervalo 35 - 50 ug). Norepinefrina total estimada que extravasou foi
de 33-80ug (intervalo de volume 1,67-4mL). Os autores concluem que nenhuma
associação significativa foi encontrada entre o uso de infusões de
norepinefrina diluída periférica e eventos adversos relacionados ao
extravasamento[22].
ESTUDO 6
Em 2019, Lewis et al. publicaram
um estudo retrospectivo, de prontuários de um hospital
universitário de atendimento terciário de Nova York, procurando avaliar a incidência
de eventos de extravasamento relacionados à administração de vasopressor por
CVP. A dose do vasopressor no momento do extravasamento foi convertida em
equivalentes de norepinefrina: Equivalentes de norepinefrina = (norepinefrina
[ug/min]) + dopamina [ug/kg/min] /2) + (epinefrina [ug/min]) + (fenilefrina [ug/min/10])
+ (vasopressina [unidades/h] x 8,33). O desfecho primário foi a incidência de
eventos de extravasamento relacionados à administração periférica de um
vasopressor. Extravasamento foi definido como “a administração extravenosa de
um medicamento ou solução que tem o potencial de causar dano grave ao tecido ou
celular no tecido circundante”. Como desfechos secundários, descreveu-se a dose,
concentração e duração do uso de vasopressor periférico, dispositivo usado para
administração de vasopressor e a frequência e tempo até a inserção do CVC. 485
pacientes receberam um vasopressor. 283 pacientes foram excluídos porque tinham
CVC no momento do início dos vasopressores. 340 cateteres periféricos
disponíveis para avaliação (a maioria dos pacientes tinha vários CVP). A duração
média total da administração de vasopressor periférico foi de 11,5 horas. Em
pacientes sem transição para CVC, a duração média da administração de
vasopressor periférico foi de 19 horas. As indicações mais comuns para
vasopressores foram choque séptico (73%) e choque cardiogênico (14%). 202
pacientes foram avaliados quanto à incidência de eventos de extravasamento
relacionados a vasopressores por meio de um CVP. A incidência foi de 4% (8/202
pacientes). O tempo médio até o extravasamento foi de 21 horas. A dose média
de vasopressor em equivalentes de norepinefrina no momento do extravasamento foi
de 0,11ug/kg/min (8ug/min). A maioria dos CVP foram passados nas veias do
antebraço (72%), fossa antecubital (54%) e mão (40%). Os dispositivos usados
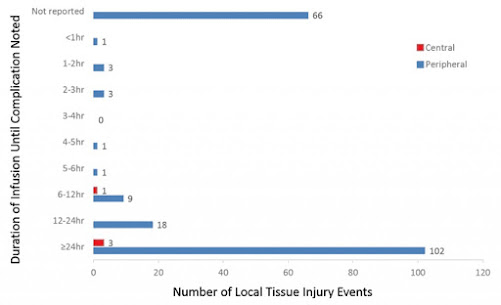
tiveram um tamanho de 18 (23%), 20(74%) e 22 (51%) gauges (Fig. 5). Não
houve isquemia ou necrose em qualquer um dos eventos de extravasamento. 6/8
eventos (75%) resultaram em lesão de grau 1 (branqueamento da pele e edema <
1 polegada). 2/8 eventos (25%) resultaram em lesão de grau 2 (branqueamento da
pele e edema 1 - 6 polegadas). 7/8 (88%) eventos resultaram no reinício do
vasopressor perifericamente. Os autores concluem que encontraram
uma incidência geral de eventos de extravasamento de 4% em pacientes recebendo
vasopressores através de um CVP que não foram inseridos sob um protocolo de segurança
estrito. Nenhum desses eventos foram graves o suficiente para exigir o uso de
um antídoto ou intervenção cirúrgica, e em 7 dos 8 casos vasopressores foram
retomados em um local periférico separado[23].
Fig.
5 Localização de eventos e cateteres usados
Tabela
2. Caraterísticas dos vasopressores usados
Da tabela apresentada no
estudo observa-se que o vasopressor mais comumente administrado foi a norepinefrina
(72%) com duração mediana de 7,5 horas (Tabela 2). A
concentração mais comum de norepinefrina usada foi 16ug/mL. A dose média de
norepinefrina foi de 0,08ug/kg/min (faixa: 0,04ug/kg/min a 0,13ug/kg/min). O
risco documentado de lesão por extravasamento de 4% neste estudo é semelhante
às taxas de extravasamento observadas em publicações anteriores (ou seja, 3 -
6%) e não houve nenhum caso de isquemia ou necrose de membro que requer
intervenção cirúrgica. Hipoteticamente, a taxa de extravasamento pode ser reduzida
ainda mais pela implementação de protocolos de observação rígidos e protocolos
de gerenciamento de extravasamento[24].
ESTUDOS 7 e 8
Em 2020, Tian et. al. publicaram
uma revisão sistemática com metanálise para avaliar a frequência de
complicações associadas à administração de vasopressores via CVP. Eles
incluíram estudos de pelo menos 20 pacientes que receberam infusões contínuas
de medicamentos vasopressores (noradrenalina, adrenalina, metaraminol,
fenilefrina, dopamina e vasopressina) administrados por CVP. Dados sobre
fatores do paciente, abordagem de canulação, protocolos de monitoramento,
dosagem e diluição de vasopressores e eventos adversos foram coletados e
resumidos. Apenas 7 estudos atenderam os critérios de inclusão, totalizando
1.382 pacientes. Noradrenalina foi o agente mais comum administrado (n = 702
episódios de administração), seguido por fenilefrina (n = 546), dopamina (n =
108), metaraminol (n = 74) e vasopressina e adrenalina (<5 pacientes). Duração
média da infusão foi de 22 h. Extravasamento ocorreu em 3,4% (IC 95%
2,5-4,7%) dos pacientes. Não houve episódios relatados de necrose de tecido ou
isquemia de membro. Todos os eventos de extravasamento foram manejados com
sucesso de forma conservadora ou com medicamentos vasodilatadores. Concluem os
autores que a administração de vasopressores via CVP, quando feito por um
período limitado, sob monitorização, sugere que extravasamento é incomum e é
improvável que leve a complicações maiores (necrose de tecido ou isquemia de
membro)[25]. Nessa mesma edição do jornal
em que a revisão sistemática foi publicada (Emergency Medicin Australasia, Volume
32, Issue2, April 2020), foi também publicado um outro estudo de retrospectivo
de Delaney A. et.al., em que avaliam se o início de drogas vasopressoras
via cateteres venosos periféricos (CVP) em comparação com cateteres venosos
centrais (CVC) em pacientes admitidos na emergência com choque séptico foi
associado a diferenças em processos de atendimento e desfechos. Foi feita uma
análise post-hoc do ensaio ARISE. Comparou participantes que tiveram uma
infusão de vasopressor iniciada através de um CVP versus CVC. O desfecho
primário foi mortalidade em 90 dias. Foram estudados 937 participantes. Destes,
389 (42%) tiveram infusão de vasopressor precoce por CVP e 548 (58%) por CVC. Concluíram
que a prática de começar uma infusão vasopressora via CVP foi comum no ensaio ARISE
e mais frequente em participantes com maior gravidade de doença. O início de um
vasopressor através de um CVP foi associado a algumas melhorias nos processos
de atendimento e, após o ajuste, não estava associado com um risco aumentado de
morte[26].
ESTUDO 9
Em fevereiro de 2021,
Prasanna N. et.al., publicaram um estudo retrospectivo (realizado
entre 2016 e 2019) visando determinar a segurança e eficácia da administração a
longo prazo de vasopressores por meio de um cateter de linha média (CLM). Um total de 248 pacientes receberam
vasopressores por meio de CLM. O tempo médio de permanência do CLM foi de
14,7 ± 12,8 dias e a duração média da infusão contínua do vasopressor foi de
7,8 ± 9,3 dias. Os vasopressores usados foram: norepinefrina (66,5%) com
dose média de 15μg/min (8 - 22) e máxima de 47μg/min (0,67μg/kg/min); epinefrina
(22,6%) com dose média de 9μg/min (4,5 - 12) e máxima de 35μg/min (0,5 μg/kg/min);
vasopressina (49,6%) com dose média de 0,04unidades/min (0,04 - 0,04) e máxima
de 0,08unidades/min; fenilefrina (63,7%) com dose média de 75μg/min (40 -130,7)
e dose máxima de 350μg/min (5μg/kg/min) e angiotensina II (2,4%) com dose média
de 50ng/kg/min (20, 80) e dose máxima de 80ng/kg/min. A taxa de complicação
precoce foi de 3,6% devido a infecção da corrente sanguínea (n = 6),
extravasamento de drogas (n = 1), tromboflebite (n = 1) e punção arterial (n =
1). A taxa de complicação tardia foi de 0,8% (n= 2) devido a TVPs associados ao
CLM. Não houve complicações relacionadas à administração ineficaz de
medicamentos ou risco de lesão em membros. Concluem os autores que os CLM são
uma alternativa segura entre os CVPs e CVCs, para a administração segura e
eficaz de vasopressores por períodos prolongados de tempo[27].
ESTUDO 10
Neste mês de abril de
2021, Owen V.S. et.al., publicaram uma revisão sistemática com metanálise,
para examinar a incidência de eventos adversos anatômicos locais associados à
administração de vasopressor através de CVP em pacientes de qualquer idade
atendidos em qualquer ambiente de cuidados intensivos. Para tanto, fizeram a
pesquisa no registro de databases do MEDLINE (OVID), EMBASE (OVID), CINAHL
(EBSCO), Cochrane Central Register of Controlled Trials (OVID), and the
Database of Abstracts of Reviews of Effects (OVID), desde o início até outubro
de 2019. A estratégia de pesquisa foi submetida a revisão por
pares. Não houve restrições por idioma, data ou país de publicação. Referências
de estudos incluídos e revisões relacionadas, bem como anais de conferências
relevantes também foram pesquisados. Os estudos foram incluídos se fossem: (1)
desenho de estudo de coorte, quase-experimental ou ensaio controlado
randomizado; (2) conduzido em humanos de qualquer idade ou ambiente clínico; e
(3) relatado sobre eventos adversos anatômicos locais associados à
administração de vasopressor por CVP. As estimativas de incidência foram
agrupadas usando metanálise de efeitos aleatórios. As análises de subgrupos
foram usadas para explorar as fontes de heterogeneidade. “Vasopressor” foi
definido como qualquer droga administrada por via intravenosa que causa
constrição dos vasos sanguíneos. “CVPs” foram definidos como cateteres
inseridos e terminando em veias periféricas (por exemplo, braços ou pernas).
Isso incluiu o cateter de linha média. “CVCs” foram definidos como cateteres
inseridos em grandes veias proximais em que a ponta do cateter terminava dentro
da circulação central. Isso incluiu a veia jugular interna, subclávia e
femoral, bem como o CVC inserido perifericamente, ou seja, PICC. Os eventos
adversos foram definidos por cada estudo individual, mas tiveram que ser
eventos anatômicos locais diretamente atribuíveis à administração de uma
infusão vasopressora por meio de um CVP (por exemplo, extravasamento,
infiltração, necrose) e não relacionados aos seus potenciais efeitos sistêmicos
(por exemplo, taquiarritmia). Para o propósito desta revisão, um estudo de
coorte foi definido como um estudo que acompanhou os participantes desde a
exposição ao desfecho, teve mais de 10 participantes e investigou pacientes que
experimentaram e não experimentaram um evento adverso.
23 estudos foram
incluídos na revisão sistemática, dos quais 16 foram em adultos e 7 em crianças.
A maioria foram estudos de coorte (n = 18, 78%), mas também incluíram ensaios
clínicos randomizados (RCTs) (n = 4, 17%). Dos estudos de coorte, a maioria foi
retrospectiva (n = 10, 43%). Entre os 16 estudos com adultos, 5 (31%)
descreveram pacientes em departamentos de emergência (DE), 6 (37%) em UTIs e os
outros 5 (31%) incluíram pacientes de uma mistura de ambientes clínicos. Entre
as crianças, as configurações clínicas incluíram a unidade de terapia intensiva
pediátrica (UTIP, n = 2, 29%), unidade de terapia intensiva neonatal (UTI
neonatal, n = 2, 29%) e uma mistura de emergência e UTIP (n = 2, 29%).
Nos 16 estudos de
adultos, a norepinefrina foi o vasopressor mais comumente administrado (15.584
casos em 9 estudos), seguida pela fenilefrina (546 casos em 4 estudos),
epinefrina (261 casos em 4 estudos) e dopamina (151 casos em 6 estudos). A
duração média da infusão do vasopressor por CVP foi relatada em 10 estudos com
adultos e variou de 1,3 a 49 h, com metade (n = 5) de estudos relatando uma
duração média entre 12 e 24 h. Nos 6 estudos com adultos que relataram o
tamanho do CVP usado para administrar vasopressores, 88% das infusões de
vasopressores foram por meio de CVPs de calibre 16–20G (1283/1464), dos quais a
maioria foi por meio de um CVP de calibre 20G (888/1464, 61%). 7 estudos de
adultos comentaram sobre a localização anatômica do CVP, dos quais 4
quantificaram quantas infusões foram registradas em cada local. Destes estudos,
64% (446/692) dos vasopressores foram administrados através de um CVP no braço
proximal ao punho e 27% (188/692) foram administrados na mão ou punho. Nos 7
estudos realizados em crianças, a idade média variou de 1 dia a 9,3 anos. A
dopamina foi o vasopressor mais comumente administrado e foi administrada a
pacientes em todos os estudos com crianças (n = 7), seguida por epinefrina (n =
4 estudos) e norepinefrina (n = 3 estudos). A maioria dos estudos em crianças (n=
5) descreveu pacientes recebendo múltiplos vasopressores, com um estudo
explicitamente descrevendo pacientes recebendo múltiplos vasopressores
simultaneamente através do mesmo CVP. A duração média da infusão foi relatada
em cinco estudos com crianças e variou de 3 a 36,5 h, com a maioria (n = 3
estudos) relatando uma duração inferior a seis horas. O calibre foi relatado em
quatro estudos com o calibre 24G como o tamanho de CVP mais comum.
20 estudos examinaram
explicitamente a ocorrência de eventos adversos graves (por exemplo, necrose ou
isquemia de membro). 19 estudos relataram evento adverso, incluindo aqueles que
foram leves, dos quais 4 estudos relataram eventos adversos graves que incluíram
tromboflebite (1 caso), descamação (2 casos) e isquemia com necrose cutânea (1
caso). Os outros 15 estudos que observaram eventos adversos descreveram
infiltração ou extravasamento levando a reações teciduais locais leves, como
edema, eritema, branqueamento, flebite, desconforto ou manchas. Descoloração
cutânea (n = 2 pacientes) foi a única complicação de longo prazo relatada nos
estudos que observaram eventos adversos mais leves. Dos 19 estudos que
relataram eventos adversos, 7 relataram a resolução dos eventos adversos sem
tratamento (exceto a remoção do CVP), 4 relataram tratamento farmacológico (por
exemplo, injeção de fentolamina e aplicação de pasta de nitroglicerina), e os
outros 8 estudos não mencionaram o uso de qualquer tratamento. Em um estudo
adulto, 3 pacientes tiveram dificuldades de acesso de CVP (por exemplo,
problemas com infusão pelo CVP ou obtenção de local de CVP) que foram
resolvidos pela obtenção de um novo local de CVP em um paciente e inserção de
um CVC nos outros dois pacientes. Um estudo em crianças relatou 4 de perda de CVP,
mas nenhum evento adverso associado (Fig. 6).
Fig.
6 Resumo dos dados da Revisão Sistemática
Metanálise de efeitos
aleatórios reunindo dados de 11 estudos com adultos (n = 16.055 pacientes) estimou
a proporção de incidência de eventos adversos associados à administração de
vasopressor por CVP como 1,8% (IC 95% 0,1–4,8%, I² = 93,7%, Cochran’s Q p
<0,001). A combinação de dados dos 4 estudos em crianças (n = 388 pacientes)
estimou a proporção de incidência de eventos adversos em 3,3% (IC de 95%
0,0–10,1%, I 2 = 82,4%, Cochran’s Q p <0,001). O teste de Begg não
demonstrou evidências de viés de publicação (p = 0,37). Veja-se
a Tabela 3 abixo.
Tabela
3. Incidência de Eventos Adversos
Esta revisão sistemática com
metanálise de eventos adversos associados à administração de vasopressor por
CVP entre mais de 16.000 pacientes de 23 estudos revelou que, tanto em adultos
quanto em crianças, o risco de eventos adversos anatômicos locais é baixo e
comparável às taxas de complicações potencialmente mais graves associado à inserção
e manutenção do CVC. A incidência combinada de eventos adversos foi baixa (1,8%
entre adultos e 3,3% entre crianças). Além da incidência geralmente baixa, 19
dos 23 estudos não relataram eventos adversos ou apenas reações teciduais
locais leves, como infiltração ou extravasamento, com apenas um estudo relatando
isquemia e necrose cutânea. É importante ressaltar que um grande número de
estudos apresentava risco elevado de viés, e havia uma heterogeneidade estatística
e clínica significativa entre os estudos. Além disso, embora a maioria dos
estudos relatou a administração de vasopressor por CVP que segue a prática
contemporânea (ou seja, CVP calibre 20G ou maior em veias proximais às mãos),
nenhum estudo comparou diretamente a incidência de eventos adversos anatômicos
locais associados a CVP em comparação com vasopressores administrados por CVC.
Portanto, os resultados desta metanálise devem ser interpretados como suporte à
hipótese de que, para muitos pacientes, a administração do vasopressor por CVP
pode ser segura, ao mesmo tempo que destaca a necessidade de pesquisas
adicionais de alta qualidade.
Embora a incidência de
eventos adversos associados à administração de vasopressores por CVP seja
baixa, é difícil fazer recomendações clínicas sem comparações diretas com a
prática atual por meio de CVCs. Elaborar um estudo para fazer essas comparações
enfrenta vários desafios. O primeiro é definir o desfecho primário de interesse,
em que os eventos adversos associados à administração de vasopressores são
diferentes para CVPs e CVCs. Extravasamento de medicamentos, isquemia local do
tecido ou perda súbita do acesso intravenoso, resultando em hipotensão grave,
são eventos que estariam mais comumente associados a vasopressores
administrados por meio de um CVP. O segundo desafio no projeto de um RCT para
examinar a administração de vasopressores por CVP é a baixa taxa de eventos
adversos associados à administração de vasopressores por meio de um CVP ou CVC
que exigiria um grande tamanho de amostra. Terceiro, é a interação da questão
de pesquisa atual comparando o uso de CVPs e CVCs para incluir também formas
mais recentes e utilizadas de acesso venoso, como PICC e cateteres de linha
média (CLM), com uma linha média funcionando mais como um CVP e o PICC mais
como um CVC. À primeira vista, essas duas formas de acesso venoso parecem mais
robustas do que um CVP e menor risco e desconforto para os pacientes do que o
CVC tradicional. No entanto, pesquisas recentes sugerem que pacientes
gravemente enfermos podem apresentar maior risco de complicações relacionadas
ao PICC, como trombo venoso profundo e relacionado ao cateter. Nenhum dos
estudos incluídos nesta revisão examinou pacientes tratados com cateteres de
linha média ou PICC. Portanto, a questão da pesquisa é provavelmente ainda mais
complexa do que aludimos e quaisquer estudos prospectivos futuros devem
considerar a inclusão de cateteres de linha média e PICC no que é provavelmente
um projeto RCT complexo. Quarto, e talvez o mais desafiador, pode ser superar a
crença arraigada entre os médicos de que medicamentos vasopressores devem ser
administrados por meio de um CVC e os efeitos dessa crença na disposição dos
médicos de inscrever pacientes em um RCT que potencialmente randomiza os
pacientes para a administração de vasopressores que não seja através de um CVC.
Embora o estudo destaque
a necessidade de pesquisas adicionais de alta qualidade, tomadas em conjunto
com as diretrizes existentes, os resultados ajudam a informar a prática clínica
atual em relação à administração de vasopressores através de CVP. As mais
recentes Diretrizes da Surviving Sepsis Campaign para o manejo de adultos com
sepse não fazem recomendações explícitas em relação à administração de vasopressor
por CVC ou CVP, embora seja destacado que os pacientes não precisam mais de
avaliação de dados especializados obtidos do CVC, como saturação venosa central
de oxigênio como parte de sua ressuscitação inicial. As diretrizes de sepse
pediátrica afirmam que se um CVC não for razoavelmente acessível, todos os
medicamentos vasoativos (incluindo epinefrina e norepinefrina) podem ser inicialmente
administrados por CVP ou acesso intraósseo (IO) para evitar atrasos e
transferir a infusão para um CVC o mais rápido possível. A análise de
sensibilidade excluindo o grande estudo em pacientes operados sugere que os
eventos adversos podem ocorrer mais comumente em pacientes de UTIs, unidades de
emergência onde infusões de vasopressores são provavelmente administradas por
períodos mais longos de tempo para pacientes com maior gravidade da doença,
embora a taxa geral ainda fosse baixa. A grande variedade de estudos
representados na revisão, a maioria dos quais relatando uma baixa incidência de
eventos adversos, sugere que, por pelo menos curtos períodos de tempo, a
administração de vasopressor por CVP é segura, desde que existam precauções
para reduzir a probabilidade de eventos adversos. Essas salvaguardas incluem
políticas institucionais que colocam limitações no tamanho e localização do CVP,
dose e duração da infusão, exigem verificações frequentes do CVP para garantir
a permeabilidade e sempre mantendo um CVP de backup em caso de perda súbita do
acesso intravenoso.
Os resultados deste
estudo devem ser interpretados no contexto de seus pontos fortes e limitações.
Foi conduzido seguindo rigorosamente as diretrizes metodológicas para
metanálises e, até onde se sabe, é a primeira metanálise a examinar a segurança
da administração de vasopressor por CVP em crianças, e a maior em adultos. No
entanto, a maioria dos estudos incluídos eram estudos de coorte retrospectivos
em um único centro, inerentemente em risco de viés de notificação e geralmente
em alto/algum risco de viés. As análises de subgrupo e metarregressão sugerem
uma redução na heterogeneidade entre os estudos com menor risco de viés, no
entanto, a estimativa de eventos adversos permaneceu semelhante. Além disso,
houve heterogeneidade significativa entre os estudos. Análises de subgrupos e
estratificadas examinando fatores conhecidos por contribuir para a
heterogeneidade clínica, como local de atendimento clínico, o tipo de
dispositivo e a duração da infusão do vasopressor foram identificados como
fatores que contribuem para a heterogeneidade estatística observada. Devido ao
relato não uniforme de dados nos estudos incluídos, não foi possível comentar
sobre as contribuições da concentração e/ou dose do vasopressor, dois fatores
considerados importantes determinantes da segurança da administração do
vasopressor por CVP. A análise de sensibilidade excluindo um grande estudo de
pacientes operados (Pancaro et al.) em que os dados foram obtidos
principalmente de um banco de dados eletrônico (em vez de revisão manual de
prontuários) e as taxas de eventos adversos foram relatadas como sendo mais
baixas, resultou em uma redução acentuada na heterogeneidade. A norepinefrina
foi o vasopressor mais usado, e isso provavelmente reflete a prática clínica na
maioria das jurisdições; no entanto, outras drogas frequentemente utilizadas,
como epinefrina e vasopressina, foram sub-representadas. As tentativas de
examinar nossos resultados em subgrupos definidos pelo tipo de vasopressor não
produziram nenhuma diferença significativa na incidência de eventos adversos,
embora a análise provavelmente tenha sido insuficiente.
Concluem os autores desta
metanálise que a incidência de eventos adversos associados à administração de
vasopressores por CVP em adultos e crianças é baixa e quando os eventos
adversos ocorrem, eles tendem a ser menores. Entretanto, pesquisas adicionais
são necessárias para examinar os efeitos da localização e tamanho do CVP, tipo,
concentração, dose e duração do vasopressor e características do paciente sobre
a segurança da administração do vasopressor pelo CVP. Entretanto, esses
resultados sugerem que, com monitoramento cuidadoso, a administração de
vasopressores por meio de CVPs é segura[28].
CONCLUSÕES DESTA REVISÃO:
Dadas as evidências
atuais revisadas, parece apropriado concluir que:
1. A necessidade de vasopressores
em si não é uma indicação obrigatória para acesso venoso central.
2. Administrar
vasopressores por meio de CVP por um período limitado, até ser providenciado o
CVC, é seguro.
3. Existe indicação clara
de administrar vasopressores por CVP em pacientes graves/críticos, hemodinamicamente
instáveis e com risco iminente de vida. Nessa situação o benefício da administração
precoce da medicação vasopressora supera amplamente o risco do prejuízo gerado
pela demora em realizar a passagem de um CVC.
4. É obrigatória a
elaboração de protocolos institucionais nos quais conste claramente a rotina de
passagem de um CVP para fins e uso de medicação vasopressora, que deverá incluir
a seleção da veia, tipo de cateter a seu usado, técnica de passagem, cuidados
e monitoramento do CVP, tempo máximo
de permanência e manejo de eventuais casos de extravasamento.
5. Dar preferência às
veias do braço (basílica e cefálica) e à veia jugular externa. Em caso de
extrema necessidade em que sejam usadas as veias da mão, punho, antebraço e
fossa antecubital (veias de maior risco) ou da extremidade inferior, manter o
CVP pelo menor tempo possível.
6. Cateterizar veias da extremidade
superior, contralateral ao manguito de pressão arterial
7. Um intervalo de 4 a 12
horas pareceria razoável pra uso de CVP, até providenciar o CVC. Nos casos de
punção guiada pela ultrassonografia em veias de > 4mm pode se manter até por
12 horas. Nos casos de CVP passados sem guia de ultrassonografia e/ou em veias
de maior risco manter por até 4 horas.
8. Quando possível, usar
a técnica de punção de acesso venoso guiado pela ultrassonografia conforme
descrita neste blog (http://blogdeterapiaintensiva.blogspot.com/),
verificando a posição do CVP dentro da veia e o retorno de sangue do acesso
venoso periférico antes da administração de vasopressor.
9. Usar preferencialmente cateteres de 18 a 20G.
10. Avaliação do acesso venoso
periférico a cada 2 horas de acordo com o protocolo de enfermagem.
11. Alerta imediata pela
equipe de enfermagem à equipe médica em caso de extravasamento, com pronto
início de tratamento local.
12. Todas as unidades nas
quais seja feita a administração de drogas vasopressoras através de CVP deverão
contar com as medicações usadas para tratar eventuais casos de extravasamento.
PREVENÇÃO E MANEJO DA
LESÃO POR EXTRAVASAMENTO[29]
[30]
[31]
[32]
PREVENÇÃO
- Evite, se possível, veias da mão/pulso/fossa antecubital e da extremidade inferior
- Use preferencialmente um protocolo de punção guiada pela ultrassonografia
- 10 mg de fentolamina podem ser adicionados a cada litro de solução contendo norepinefrina. O efeito pressor da norepinefrina não é afetado.
- Use a concentração de vasopressor mais diluída possível.
- Use o menor volume possível de vasopressor.
TRATAMENTO
1. Medida Inicial
- Suspender a infusão do vasopressor.
- Providenciar outro acesso (IV, IO ou CVC).
- Mantenha o CVP inserido e aspire o máximo que puder.
- Não aplique pressão local.
2. Mesilato de Fentolamina SC e EV. (Frasco com 5mg/ml com 1ml)
- Uma dose de 0,1 a 0,2 mg/kg (até um máximo de 10 mg) deve então ser injetada através do cateter e por via subcutânea ao redor do local, dentro das 12 horas do evento.
- Dilua 5mg (1ml) + 9ml de SF 0.9%) ou10mg (2ml) + 8ml de SF 0.9%.
- Injete 5ml através do CVP e os 5ml restante ao redor do local usando uma agulha de 25G ou 27G.
- Administrar assim que o extravasamento for detectado.
- Deve ver os efeitos imediatos próximos; caso contrário, considere uma dose adicional.
- Agora retire o CVP.
- Pode causar hipotensão sistêmica (mas eles devem estar com pressores em outro local.
3.Terbutalina
- Com alternativa à fentolamina
- Extravasamento digital: 0,5 mg (1mg/ml) SC na área de extravasamento
- Extravasamento de extremidades: 1mg diluído em 10ml de SF 09%. Injete 5ml pelo CVP e os 5ml restante ao redor do local usando uma agulha de 25G ou 27G.
- Deve ver os efeitos imediatos próximos; caso contrário, considere uma dose adicional.
4. Nitroglicerina Tópica
- Como adjuvante a fentolamina ou terbutalina
- 4 mm/kg de pomada a 2% na área afetada
- Pode repetir a dose de 8/8 horas
5. Outras medidas
- Aplique compressas mornas por 20 minutos de 6/6h ou de 8/8h nas primeiras 24 a 48 horas do evento.
- Caso a lesão evolua para necrose solicite avaliação da cirurgia para desbridamento
[1]Humphreys J, Johnston JH,
Richardson JC. Skin necrosis following intravenous noradrenaline. Br Med J
1955;2:1250–2.
[2] Weeks PM. Ischemia of the hand
secondary to levarterenol bitartrate extravasation. Methods of management. JAMA
1966;196:288–90.
[3] Oglesby JE, Baugh JH. Tissue
necrosis due to norepinephrine. Am J Surg 1968;115:408–12.
[4] Kim SM, Aikat S, Bailey AWell
recognised but still overlooked: norepinephrine extravasationCase Reports
2012;2012:bcr2012006836.
[5] Bhosale GP, Shah VR. Extravasation injury due to dopamine infusion
leading to dermal necrosis and gangrene. J Anaesthesiol Clin Pharmacol 2012;28:534-5
[6] Parienti JJ, Mongardon N,
Megarbane B, Mira JP, Kalfon P, Gros A, et al. Complicações intravasculares do
cateterismo venoso central por local de inserção. N Engl J Med. 2015; 373 (13):
1220–9.
[7]https://www.crit.cloud/summaries--reviews/7-reasons-for-the-use-vasopressors-through-peripheral-catheters
[8] https://first10em.com/peripheralperssors/
[9] https://www.nuemblog.com/blog/peripheral-vasopressors
[10] https://rebelem.com/one-more-update-on-using-peripheral-intravenous-piv-vasopressors/
[11]https://journalfeed.org/article-a-day/2019/peripheral-pressors-for-all-complications-with-peripheral-norepinephrine-infusion
[12] https://rebelem.com/peripheral-vasopressors-safe-dangerous/
[13] https://rebelem.com/rebel-cast-ep73-are-peripheral-vasopressors-safe/
[14] https://rebelem.com/one-more-update-on-using-peripheral-intravenous-piv-vasopressors/
[15] J Hosp Med. 2015 Sep;10(9):581-5.
doi: 10.1002/jhm.2394. Epub 2015 May 26.
[16] Ricard JD, Salomon L, Boyer A,
Thiery G, Meybeck A, Roy C, Pasquet B, Le Mière E, Dreyfuss D. Central or
peripheral catheters for initial venous access of ICU patients: a randomized
controlled trial. Crit Care Med. 2013 Sep;41(9):2108-15. doi:
10.1097/CCM.0b013e31828a42c5. PMID: 23782969.
[17] Cardenas-Garcia J, Schaub KF,
Belchikov YG, Narasimhan M, Koenig SJ, Mayo PH. Safety of peripheral
intravenous administration of vasoactive medication. J Hosp Med. 2015
Sep;10(9):581-5. doi: 10.1002/jhm.2394. Epub 2015 May 26. PMID: 26014852.
[18] Loubani OM et al. A systematic
review of extravasation and local tissue injury from administration of
vasopressors through peripheral intravenous catheters and central venous
catheters. J Crit Care 2015; 30 (3): 653.e9 – 653.e17. PMID: 25669592
[19] https://rebelem.com/mythbuster-administration-of-vasopressors-through-peripheral-intravenous-access/
[20] https://first10em.com/peripheralperssors/
[21] Medlej K et al. Complications from
Administration of Vasopressors Through Peripheral Venous Catheters: An
Observational Study. JEM 2018. PMID: 29110979
[22] Pancaro C et al. Risk of Major
Complications After Perioperative Norepinephrine Infusion Through Peripheral
Intravenous Lines in a Multicenter Study. Anesth Analg 2019. PMID: 31569163
[23] Lewis T, Merchan C, Altshuler D,
Papadopoulos J. Safety of the Peripheral Administration of Vasopressor Agents.
Journal of Intensive Care Medicine. 2019;34(1):26-33.
doi:10.1177/0885066616686035
[24] https://rebelem.com/one-more-update-on-using-peripheral-intravenous-piv-vasopressors/
[25] Tian D. H. et.al., Safety of
peripheral administration of vasopressor medications: A systematic review. Emergency
Medicin Australasia. Volume32, Issue2, April 2020, pages 220-227.
[26] Delaney A. et.al., Initiation of
vasopressor infusions via peripheral versus central access in patients with
early septic shock: A retrospective cohort study. Emergency Medicin Australasia.
Volume32, Issue2, April 2020,
pages 210-219.
[27] Prasanna N, Yamane D, Haridasa N,
Davison D, Sparks A, Hawkins K. Safety and efficacy of vasopressor
administration through midline catheters. J Crit Care. 2021 Feb;61:1-4. doi:
10.1016/j.jcrc.2020.09.024. Epub 2020 Oct 2. PMID: 33049486.
[28] Owen, V.S., Rosgen, B.K., Cherak,
S.J. et al. Adverse events associated with administration of vasopressor
medications through a peripheral intravenous catheter: a systematic review and
meta-analysis. Crit Care 25, 146 (2021). https://doi.org/10.1186/s13054-021-03553-1
[29] https://rebelem.com/rebel-cast-ep73-are-peripheral-vasopressors-safe/
[30] https://emcrit.org/emcrit/peripheral-vasopressors-extravasation/
[31]https://dailymed.nlm.nih.gov/dailymed/fda/fdaDrugXsl.cfm?setid=ed6c506c-5535-4b7c-ae1a-d63f09d796c9&type=display#:~:text=For%20Prevention%3A%2010%20mg%20of,of%20extravasation%20within%2012%20hours.
[32] Lewis T, Merchan C, Altshuler D,
Papadopoulos J. Safety of the Peripheral Administration of Vasopressor Agents.
Journal of Intensive Care Medicine. 2019;34(1):26-33.
doi:10.1177/0885066616686035








Nenhum comentário:
Postar um comentário