TROMBÓLISE E INVESTIGAÇÃO DE DISSECÇÃO AGUDA DE AORTA.
PAPEL DO
ALARGAMENTO DO MEDIASTINO
Dr. Alejandro Enrique Barba Rodas. Médico intensivista. Responsável Técnico e Coordenador da Unidade Coronariana da Santa Casa de São Jose dos Campos.
O exame de radiografia (RX) na
avaliação do tórax representa o método de imagem mais antigo, mais barato, mais
disponível, utilizado para avaliação das doenças torácicas. Está disponível
tanto a nível hospitalar como extra-hospitalar (unidades de pronto atendimento)
e ainda pode ser feito por equipamentos portáteis, permitindo a realização de
exames à beira do leito de pacientes acamados no centro cirúrgico, unidades de
terapia intensiva ou nas salas de atendimento de urgência e trauma. Entretanto,
apesar da sua ampla disponibilidade e versatilidade, sua acurácia,
sensibilidade e especificada no auxílio do diagnóstico por imagem depende de vários
fatores como, caraterísticas do paciente (tipo de doença, anatomia do tórax,
localização da estrutura dentro do tórax etc.), tipo de equipamento usado (fixo
ou portátil), incidência (póstero-anterior, anteroposterior, perfil, obliqua,
etc.) assim como os parâmetros técnicos a serem utilizados (grau de penetração
da radiação, inspiração correta e alinhamento). A radiografia de tórax padrão com o paciente
em ortostase (de pé), em inspiração profunda e na incidência P-A e em perfil,
realizada por um equipamento fixo na sala de RX, com uma distância entre o
paciente e a ampola (distância foco-paciente) de 1,5 – 1,8 metros, não é possível
na grande maioria dos pacientes graves que usualmente estão acamados e em decúbito
dorsal. Devido à distância entre a ampola emissora de feixes de raio X e o
detector, a imagem em P-A é preferida em relação à A-P, pois aproxima o coração
do detector e reduz sua magnificação. Os feixes do raio X, após emitidos pela
ampola, se divergem até chegar no paciente e no detector. As estruturas mais
próximas do detector vão se apresentar com o tamanho mais próximo ao real, sem magnificação.
Na radiografia feita em A-P, a divergência dos raios aumenta a sombra do
coração, que é mais anterior no tórax. Em pacientes deitados, as costelas
posteriores apresentam-se mais horizontais. O diafragma está mais alto e o
volume pulmonar diminuído A posição em A-P, portanto, cria uma imagem radiográfica
de maiores dimensões o que poderia gerar uma falsa impressão de que a estrutura
avaliada se encontra aumentada de tamanho (tórax pouco inspirado, mediastino
alargado, aumento da área cardíaca, diafragma elevado, parênquima pulmonar mais
opacificado). Note-se abaixo a imagem comparativa do mesmo paciente em pé e
deitado (Fig. 1)[1].
Fig 1. Radiografia do tórax em PA ortostático (esquerda) e AP deitado (direita). Notar a diferença de qualidade das imagens, sendo que a imagem em PA permite melhor avaliação dos pulmões e estruturas mediastinais.
Uma das situações de maior
complexidade na qual a radiografia de tórax tem muita importância e relevância é
na avaliação do mediastino para descartar uma dissecção aguda de aorta (DAA) visando
indicar trombólise num paciente com diagnóstico de infarto agudo de miocárdio com
supradesnivelamento do segmento ST (IAMCSST) com um tempo porta-balão maior de
120 minutos. No cenário extra-hospitalar isso é relativamente frequente nas
unidades de pronto atendimento (UPAs) que não contam com retaguarda de unidade
de hemodinâmica para realização de cinecoronarioangiografias de urgência ou as
mesmas estão com todas suas salas ocupadas. Ainda, no cenário intra-hospitalar isso
também pode ser possível para pacientes que se encontram nas salas de emergência
do pronto socorro (PS) ou nas unidades de terapia intensiva (UTI).
Nas situações em que o tempo
porta-balão for maior do que 120 minutos ou não se disponha de serviço de
cardiologia intervencionista com equipe experiente e apta a realizar intervenção
coronariana percutânea (ICP) primária, recomenda-se a trombólise do IAMCSST.
Entretanto, antes de indicar o fibrinolítico as diretrizes orientar avaliar as
contraindicações absolutas relativas. Uma das contraindicações absolutas listas
é a dissecção aguda de aorta (DAA). Sendo absoluta, torna-se obrigatório
afastar essa possibilidade.
Nesse sentido a V Diretriz Brasileira
de Infarto Agudo de Miocárdio com Supradesnivelamento do Segmento ST (2015), faz
a seguinte recomendação sobre o uso de fibrinolíticos como terapia de
reperfusão[2]:
De acordo com as evidências disponíveis, nas situações de atendimento pré-hospitalar, o retardo máximo aceitável para a realização da estratégia invasiva de ICP primária é de 120 minutos ou, idealmente, 90 minutos, considerando-se, para esses casos, o intervalo de tempo entre o “primeiro contato médico-balão”. Na impossibilidade de ICP ou expectativa de tempo “primeiro contato médico-balão” superior a 90 minutos, o uso de fibrinolítico deve ser uma opção, desde que não haja contraindicação. (grifei)
Os
fibrinolíticos têm indicação clara nos pacientes com sintomas sugestivos de
SCA, associada a presença, no ECG, de supradesnivelamento persistente do
segmento ST em pelo menos duas derivações contíguas ou de um novo ou
presumivelmente novo BRE, desde que não existam contraindicações. (grifei)
As diretrizes citadas estabelecem uma lista de contraindicações como mostrado no quadro abaixo, destacando a DAA como contraindicação absoluta:
Torna-se, portanto, um grande
desafio descartar, a possibilidade de DAA.
A dissecção aguda de aorta
consiste em um evento no qual ocorre uma laceração na camada íntima do vaso,
acarretando a formação de um falso lúmen, geralmente entre as camadas média e
adventícia. Essa falsa luz é produzida pela infiltração de sangue, dado o
evento de delaminação anterógrada e retrógrada de suas paredes, sendo separada
da luz verdadeira por um septo denominado retalho de dissecção[3].
Diante da suspeita clínica e radiológica (Rx de tórax), após a estabilização, a
confirmação diagnóstica é feita com Ecocardiograma transesofágico I (ETE),
angiografia de aorta por TC (angio-TC de aorta) ou angiografia por ressonância
magnética (angio-RM). Os achados de retalho de íntima e lúmen duplo confirmam a
dissecção[4].
Classificação da Dissecção Aguda
de Aorta[5]:
CLASSIFICAÇÃO DE STANFORD:
Tipo A: envolvimento da aorta
ascendente
Tipo B: envolvimento da aorta
descendente (distal à origem da artéria subclávia esquerda)
CLASSIFICAÇÃO DEBAKEY:
Tipo I: A mais frequente. A
disseção tem origem na aorta ascendente e envolve a aorta descendente.
Tipo II: A disseção envolve
apenas a aorta ascendente.
Tipo III: A disseção envolve
apenas a aorta descendente (distal à artéria subclávia).
Tipo IIIa: termina acima do
diafragma
Tipo IIIb: estende-se inferiormente
ao diafragma
Em cenários sem possibilidade de
realizar ETE, angio-TC ou angio-RM imediatas, a suspeita clínica deve ser
aprimorada. Para tanto, a SUSPEITA CLÍNICA é de suma importância[6].[7]:
FATORES PREDISPONENTES: Hipertensão
arterial sistêmica (HAS), valva aórtica bicúspide, doenças do tecido conectivo
(síndrome de Marfan, Síndrome de Ehlers-Danlos, Síndrome de Loeys-Dietz), coarctação
da aorta, aneurisma da aorta, cirurgia cardíaca prévia, gravidez e trauma
torácico.
DOR. Tipicamente a
dissecção aórtica, caracteriza-se pelo desenvolvimento abrupto de dor
precordial ou interescapular excruciante, com frequência descrita como lancinante,
dilacerante ou violenta. Em geral, a dor migra da localização original, à
medida que a dissecção se estende ao longo da aorta.
SÍNCOPE. Até 20% dos
pacientes desenvolvem síncope em virtude da intensidade da dor, ativação do
barorreceptor aórtico, obstrução de artéria cerebral extracraniana ou
tamponamento cardíaco. Hipotensão e taquicardia podem indicar sangramento
ativo.
SINAIS DE MÁ PERFUSÃO. Às
vezes, os pacientes apresentam sintomas de má perfusão (isquemia por obstrução
resultante da dissecção), como acidente vascular encefálico, infarto do
miocárdio, infarto intestinal, insuficiência renal, paraparesia ou paraplegia
decorrentes da interrupção do suprimento sanguíneo a um leito vascular específico,
incluindo medula espinal, cérebro, coração, rins, intestino ou extremidades. A
interrupção do suprimento sanguíneo ocorre com mais frequência por obstrução
aguda distal da artéria pela falsa luz. Oclusão de uma artéria do membro pode
causar sinais de isquemia periférica ou neuropatia. A oclusão de artéria renal
pode provocar anuria ou oligúria.
PULSOS E PRESSÃO ARTERIAL.
Cerca de 20% dos pacientes têm déficits parciais ou completos dos principais
pulsos arteriais, os quais podem aumentar e diminuir. Pode haver diferença nos
pulsos na pressão arterial dos membros superiores > 20mmHg (às vezes > 30
mmHg) devido à dissecção da artéria inominada ou da subclávia. Hipertensão
arterial ocorre quando há dissecção aórtica distal; enquanto a hipotensão e
choque circulatório estão associados à dissecção proximal, além de resultar de
situações como tamponamento cardíaco, insuficiência aórtica grave, ruptura
aórtica intrapleural/ peritoneal. O tamponamento cardíaco pode provocar pulso
paradoxal e distensão venosa jugular.
SOPROS. Sopro carotídeo
intenso, devido à dissecção da inominada ou da artéria carótida. Sopro de
regurgitação aórtica é auscultado em cerca de 50% dos pacientes com dissecção
proximal devido à dissecção dos folhetos valvares aórticos, que podem se
deformar e prolapsar para o ventrículo durante a diástole. Sopro diastólico,
audível no foco aórtico e aórtico acessório, com irradiação para o ictus. É
possível ouvir sopro de regurgitação aórtica.
SINDROME NEUROLOGICA. Pode
ocorrer AVC (acidente vascular cerebral), quando há acometimento da artéria
inominada ou carótida esquerda; ocorre paraplegia ou paraparesia quando
compromete a artéria espinal.
SINDROME CORONARIANA. Infarto Agudo do Miocárdio (IAM) secundário a
dissecção proximal que oclui o óstio coronário, mais comumente a artéria
coronária direita, acarretando infarto da parede inferior. Pacientes com dor
torácica de forte intensidade, alterações eletrocardiográficas de infarto do
miocárdio agudo de parede inferior e sopro previamente não documentado de
insuficiência aórtica (IA) devem suscitar alta suspeita de dissecção da aorta
tipo I até a artéria coronária direita (causando infarto do miocárdio de parede
inferior) e da valva aórtica (causando insuficiência aórtica)
PAPEL DA RADIOGRAFIA DE TÓRAX[8]
[9]
[10].
Os pacientes devem ser submetidos
à radiografia do tórax e, em 60 a 90% dos casos, evidencia-se ALARGAMENTO DO
MEDIASTINO, geralmente com abaulamento localizado, que significa ponto de
origem. O derrame pleural esquerdo é comum devido a vazamento de sangue ou
líquido seroso inflamatório no espaço pleural esquerdo (Fig2). Contudo, possui
limitada sensibilidade, especialmente para as dissecções do tipo B de Stanford.
O exame normal não afasta o diagnóstico.
Fig 2. Achados radiológicos.
Como interpretar corretamente
a Radiografia de tórax diante da suspeita clínica de DAA?
A acurácia da radiografia simples
de tórax deriva sua capacidade de discernir os contornos da aorta devido ao
contraste entre os pulmões cheios de ar e a aorta cheia de líquido. Os
contornos normais da aorta são bastante familiares e geralmente muito bem visualizados.
A Fig. 3 exibe uma radiografia de tórax normal, bem como uma com locais
marcados onde a aorta dilatada pode se manifestar.
Fig 3. Rx de tórax com linhas de visualização
da aorta.
Na Fig. 4, vemos exemplos de
imagens de aneurismas torácicos diagnosticados por radiografia de tórax.
Fig. 4. Aneurismas de aorta torácica.
3A: A aorta ascendente, substancialmente
aumentada, aparecerá fora da silhueta cardíaca superior direita.
3B: O botão aórtico normalmente
deve ser pequeno e distinto no mediastino superior esquerdo. Este botão
aumentará no caso de aneurisma de arco. O botão fica indistinto em pacientes
com dissecção aórtica, devido ao edema e hemorragia nos tecidos.
3C. A aorta descendente
normalmente forma uma faixa limpa e nítida à esquerda da coluna vertebral.
Observa-se claramente a dilatação aneurismática da aorta descendente, com
abaulamento desta faixa à direita.
Além disso, em casos de aumento grave da aorta, a traqueia, o brônquio principal esquerdo ou o esôfago podem ser observados deslocados em uma radiografia simples de tórax.
Pode haver separação da
calcificação intimal (SINAL DO CALCIO) ≥ 1 cm (10mm) do contorno
externo do botão aórtico; presença de DUPLA DENSIDADE (DUPLO CONTORNO) ou
PERDA DO BOTÃO AÓRTICO (Fig. 5, 6, 7, 8).
Fig. 5. O SINAL DE CÁLCIO é um achado na radiografia de tórax
que sugere dissecção da aorta. É a separação da calcificação íntima da borda
externa do tecido mole da aorta em 10 mm. Este não é um sinal importante para
os radiologistas, visto que raramente é visto. A distância indicada pela seta
representa a espessura da parede do aneurisma. Figura cortesia do Dr. MJ
Fuller. Fonte: http://www.wikiradiography.net/.
Fig 6. SINAL DO CÁLCIO
Fig 7. Sinal do DUPLO CONTORNO OU
DUPLA DENSIDADE.
Fig 8. PERDA DO BOTÃO AÓRTICO
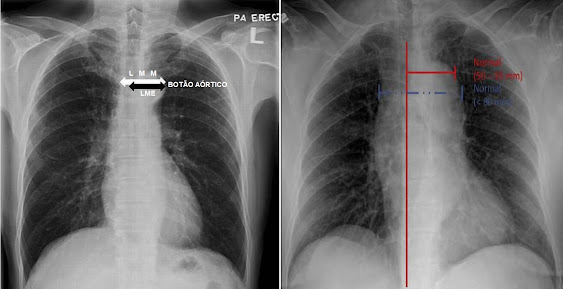
LARGURA MEDIASTINAL
As diretrizes da American Heart
Association e do American College para doença da aorta torácica (2010)
recomendam a avaliação da largura mediastinal em pacientes avaliados para
dissecção aórtica se o índice de suspeita for baixo. No entanto, deve-se ter em
mente que seu valor diagnóstico na dissecção aórtica é limitado e que mais de
10% dos pacientes podem apresentar radiografia de tórax normal.
“Alargamento de mediastino” ou
“mediastino alargado” é definido como mediastino com largura mediastinal
máxima (LMM) > 6 cm em uma radiografia de tórax póstero-anterior (P-A)
vertical ou > 8 cm em radiografia de tórax ântero-posterior em decúbito
dorsal (A-P) medido a nível do botão aórtico[11] [12].
O valor de 8 cm vem do estudo publicado em 1976 por Donald G. Marsh e col., medindo
mediastino em pacientes com ruptura traumática de aorta, em decúbito dorsal, na
incidência AP e com o gerador a 100 cm do tórax[13].
Outros estudos têm seguido esse mesmo valor para ruptura traumática de aorta, mas
raramente em ruptura aórtica torácica não traumática ou dissecção aórtica, que
é muito mais comum, mas muitas vezes menos enfatizada e com pouca atenção
recebida. A largura mediastinal para trauma de aorta tem sido o critério mais
comumente utilizado, com um valor de corte citado variando de 7,3 a 9,4 cm. Apesar
de sua precisão diagnóstica relativamente baixa com especificidade
significativamente baixa, descobriu-se que era a ferramenta radiográfica mais
poderosa e melhor especificidade foi observada com o uso da largura
mediastinal esquerda (LME), medida desde a linha média da traqueia até a
borda lateral esquerda do mediastino ao nível do arco aórtico e da razão de
largura mediastinal (RLM = LMM/LME)[14].
Em 2012, Vincent Lai e col.,
revisaram retrospectivamente todos os casos de dissecção aórtica aguda suspeita
ou confirmada que tiveram radiografia de tórax e tomografia computadorizada de
tórax realizadas durante a mesma admissão de emergência durante um período de 6
anos, de 2005 a 2010. O objetivo foi explorar a acurácia diagnóstica de várias
medidas mediastinais na determinação da dissecção aguda da aorta torácica não
traumática em relação às radiografias de tórax posteroanterior (PA) e
ântero-posterior (AP) excluíndo aqueles que apresentavam história prévia de
trauma ou doença aórtica. A largura mediastinal máxima (LMM) e a largura máxima
do mediastino esquerdo (LMME) foram medidas por dois radiologistas independentes
e a razão da largura mediastinal (RLM) foi calculada (LMM/LMME). A incidência P-A
foi significativamente mais precisa que a projeção A-P, alcançando maior
sensibilidade e especificidade. LMME e LMM foram os parâmetros mais poderosos
nas radiografias de tórax em incidências P-A e A-P, respectivamente. Os níveis
de corte ideais foram, para incidência P-A: LMME = 4,95 cm (sensibilidade, 90%;
especificidade, 90%) e LMM = 7,45 cm (sensibilidade, 90%; especificidade,
88,3%) e para incidência A-P: LMME = 5,45 cm (sensibilidade, 76%;
especificidade, 65%) e LMM = 8,65 cm (sensibilidade, 72%; especificidade, 80%).
A RLM foi considerada menos útil e menos confiável. O uso isolado de LMME na
incidência P-A permitiria uma previsão mais precisa da dissecção aórtica. A
radiografia de tórax P-A tem maior precisão diagnóstica quando comparada à
radiografia de tórax A-P, com a radiografia de tórax P-A negativa mostrando
menor probabilidade de dissecção aórtica (Fig. 9, 10)[15].
Fig. 9. Medição da Largura Mediastinal
Máxima (LMM)
e Largura Máxima Mediastinal Esquerda
(LME)
Fig. 10. Exemplos de alargamento
mediastinal na Rx de tórax em A-P
Tomando com referência o estudo
de Lai, tem se adotado como cut-off de referência definir alargamento
mediastinal a nível do botão aórtico na radiografia de tórax em A-P, os valores
de 8-9 cm para LMM e 5 – 5.5 para LME. Estes valores darão sustento
à hipótese de DAA no contexto clínico correspondente e, portanto, à
contraindicação de trombólise.
Aqui um vídeo que traz
importantes informações sobre o assunto:
Fonte: https://www.youtube.com/watch?app=desktop&v=XxnbXgMpKmQ
Deve se encorajar a elaboração de
PROTOCOLOS DE TROMBÓLISE devidamente validados pelos gestores
correspondentes tanto a nível hospitalar quanto extra-hospitalar, que incluam
definições claras das indicações e das contraindicações, dos exames a serem
previamente feitos (laboratório, eletrocardiograma e de imagem) antes durante e
após trombólise; da forma correta de administração do trombolítico, sua
monitorização e possíveis efeitos adversos; assim como orientações de como
proceder quando não se tenham dados e informações para estabelecer as
contraindicações ou quando se trate de contraindicações relativas em que a
decisão deva ser tomada analisando os riscos versus os benefícios de forma
compartilhada com o paciente ou seu responsável legal. Da mesma forma tais
protocolos deverão conter fluxogramas de atendimento e check-list de avaliação
das contraindicações.
[1]
Wada DT, Rodrigues JAH, Santos MK. Aspectos técnicos e roteiro de análise da
radiografia de tórax. Medicina (Ribeirão Preto) [Internet]. 15 de outubro de
2019 [citado 26 de agosto de 2023];52(supl1.):5-15. Disponível em:
https://www.revistas.usp.br/rmrp/article/view/154763
[2]
V Diretriz da Sociedade Brasileira de Cardiologia sobre Tratamento do Infarto
Agudo do Miocárdio com Supradesnível do Segmento ST. Arq Bras Cardiol. 2015;
105(2):1-105
[3] https://www.sanarmed.com/disseccao-aguda-de-aorta
[4]
https://www.msdmanuals.com/pt/profissional/doen%C3%A7as-cardiovasculares/doen%C3%A7as-da-aorta-e-seus-ramos/dissec%C3%A7%C3%A3o-da-aorta
[5] https://www.lecturio.com/pt/concepts/dissecao-aortica/
[6]
https://www.msdmanuals.com/pt/profissional/doen%C3%A7as-cardiovasculares/doen%C3%A7as-da-aorta-e-seus-ramos/dissec%C3%A7%C3%A3o-da-aorta
[7]
Cedália Rosane Campos dos Santos, Thays Dornelles Gandolfi, Marco Antônio
Goldani. Dissecção de aorta – diagnóstico diferencial e manejo. https://docs.bvsalud.org/biblioref/2018/02/879700/disseccao-de-aorta-diagnostico-diferencial-e-manejo-cedalia-campos.pdf
[8] Anneke
Damberg, Bulat A. Ziganshin, John A. Elefteriades, Chapter 12 - Chest X-Ray in
Aortic Disease, Editor(s): Ion C. Ţintoiu, Adrian Ursulescu, John A.
Elefteriades, Malcolm John Underwood, Ionel Droc, New Approaches to Aortic
Diseases from Valve to Abdominal Bifurcation, Academic Press, 2018, Pages
129-131,
[9] Emmanuel
Salinas Miranda e col., Enfoque inicial de las alteraciones mediastinales:
revisión de sus referencias anatómicas radiográficas. Rev. Colomb. Cardiol. vol.25 no.6 Bogota Nov./Dec. 2018. https://doi.org/10.1016/j.rccar.2017.10.010
[10] https://radiopaedia.org/articles/aortic-dissection
[11] Wackerman L, Gnugnoli DM. Widened
Mediastinum. [Updated 2023 Jul 24]. In: StatPearls [Internet]. Treasure Island
(FL): StatPearls Publishing; 2023 Jan-. Available from:
https://www.ncbi.nlm.nih.gov/books/NBK539890/
[12] Hanna M, Elshimy G, Ismail M,
Ismail M. An Unusual Benign Cause of an Alarming Finding on Chest-X ray: A Case
Report of Widened Mediastinum due to Rare Congenital Abnormality (Azygos Vein
Continuation of Inferior Vena Cava). Case Rep Crit Care. 2019 Dec
9;2019:3457495. doi: 10.1155/2019/3457495. PMID: 31885936; PMCID: PMC6925908.
[13] Marsh D. G., Sturm J. T.
Traumatic aortic rupture: roentgenographic indications for angiography. The
Annals of Thoracic Surgery. 1976;21(4):337–340. doi:
10.1016/S0003-4975(10)64323-8
[14] Wong YC, Ng CJ, Wang LJ, Hsu KH, Chen CJ. Left
mediastinal width and mediastinal width ratio are better radiographic criteria
than general mediastinal width for predicting blunt aortic injury. J
Trauma. 2004;57:88–94. doi: 10.1097/01.TA.0000082158.49654.E7.
[15]
Lai V, Tsang WK, Chan WC, Yeung TW. Diagnostic accuracy of mediastinal width measurement on posteroanterior
and anteroposterior chest radiographs in the depiction of acute nontraumatic
thoracic aortic dissection. Emerg Radiol. 2012 Aug;19(4):309-15. doi:
10.1007/s10140-012-1034-3. Epub 2012 Mar 14. PMID: 22415593; PMCID: PMC3396328.