ASPECTOS SOBRE LESÃO
PULMONAR INDUZIDA PELA VENTILAÇÃO MECÂNICA E PELO ESFORÇO RESPIRATÓRIO.
Dr. Alejandro Enrique Barba Rodas. Médico Intensivista. Coordenador da Unidade Coronariana da Santa Casa de São Jose dos Campos.
A literatura apresenta já
bastante evidência sobre os efeitos deletérios da ventilação mecânica,
especialmente no seu modo controlado não associado a uma estratégia protetora.
Esta lesão secundária tem se denominado Lesão Pulmonar Induzida pela Ventilação
Mecânica (VILI ou LPIVM)[1].
Entretanto, adotar modalidades
assistidas ou assisto-controladas, isto é, deixando que o paciente realize esforço
respiratório ou ventilação espontânea (VE) durante a ventilação mecânica (VM)
proporciona vantagens importantes, que incluem a otimização da oxigenação e
menor disfunção diafragmática (evita-se a atrofia pelo desuso). Em
contrapartida, sérias desvantagens também têm sido descritas, incluindo aumento
da lesão ao pulmão e ao diafragma e potencialmente menor sobrevida. Esta outra
forma de lesão em pacientes sob ventilação mecânica, tem sido denominada Lesão
Pulmonar Induzida pelo Esforço Respiratório (LPIER). Os efeitos do esforço
respiratório espontâneo em pacientes com insuficiência respiratória acoplados à
ventilação mecânica tem sido já descritos com efeitos benéficos na SARA leve e
lesivos na SARA grave chegando-se a propor o termo “patient self-inflicted lung
injury (P-SILI)” ou autolesão pulmonar provocada pelo paciente, como a situação
na qual um alto esforço respiratório provocado
por uma lesão pulmonar local pode resultar em agravamento da lesão pulmonar
inicial[2].
Entretanto, esse conceito não tem sido universalmente aceito[3]
[4].
Recentemente, Amato M. e col.
publicaram artigo abordando o assunto cujas considerações servem de base para
esta revisão[5].
Evidentemente, a ventilação
espontânea (drive respiratório) é um requisito absoluto para o sucesso do
desmame e, portanto, deve ser um objetivo em todos os pacientes em ventilação
mecânica. Enquanto o foco tradicional na síndrome do desconforto respiratório
agudo (SARA) está no controle e monitorização da respiração pelo ventilador,
recentes avanços apontam para diferenças importantes entre as ventilações
espontâneas e mecânicas em termos de fisiopatologia e monitorização.
MONITORIZAÇÃO DA VENTILAÇÃO MECÂNICA:
Durante a ventilação mecânica
controlada (ou seja, sem drive espontâneo), a entrega de ar é preferencialmente
distribuída nas regiões de pulmão não dependentes (“baby lung”), em parte
devido à predominância de atelectasia nas regiões dependentes. Isso explica por
que, durante a VM com uso de bloqueio neuromuscular, a região não dependente é
uma das áreas mais suscetíveis de sofrer Lesão Induzida pela VM (VILI ou
LPIVM). Para evitar essa lesão, tenta-se limitar o volume corrente (VC), a
pressão das vias aéreas (Pva) ou, em alguns casos, a pressão transpulmonar (PTP
= Pva - Ppl), bases da denominada Estratégia Protetora de Ventilação Mecânica.
A Pva pode ser decomposta de forma simples em duas partes que se somam: a pressão resistiva (relacionada à passagem do gás pelas vias aéreas até os alvéolos pulmonares) e a pressão elástica (decorrente do estiramento do parênquima pulmonar e da caixa torácica quando da acomodação do volume de gás insuflado nos alvéolos). A pressão elástica é aquela medida quando o fluxo = zero e, portanto, corresponde a pressão alveolar. A pressão resistiva por sua vez é medida na vigência de fluxo e é resultante do produto do fluxo de gás e da resistência das vias aéreas, enquanto a pressão elástica resulta da relação entre o volume inspirado e a complacência estática do sistema (por sua vez relacionada à retração elástica do parênquima pulmonar e da caixa torácica). Além disso, a presença de um dado nível de pressão “basal” ao final da expiração e logo antes do início da inspiração (PEEP) também contribui para a composição final da pressão na via aérea.
A equação abaixo ilustra os componentes matemáticos que compõem a Pva:
Pva = Presistiva + Pelástica + PEEP – Pmus
A Pmus = zero na ventilação controlada, isto é, sem esforço muscular respiratório. Logo,
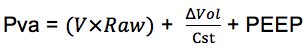
Portanto, a Pressão da Via Aérea (Pva) vai depender da pressão resistiva (Pres), que gera o fluxo de
ar através das vias aéreas e depende da resistência oferecida pelo tecido e pelo
tubo endotraqueal; e a pressão alveolar (Palv), que distende os alvéolos e a
parede torácica. Assim, a Pressão de Pico (Ppi) compreende o componente
resistivo e alveolar. No final da inspiração, quando o fluxo de ar é zero, não
há mais componente “resistivo”, a pressão resultante denominada Pressão de
Platô (Pplt) reflete a pressão que distende efetivamente os alvéolos e a parede
torácica. Portanto, é na fase de platô
(quando o fluxo inspiratório = 0) e não a fase de pico, que se reflete melhor a
distensão máxima dos alvéolos e sua tendência a lesão. Essa distensão alveolar
pode ser aferida:
1) Pela Pva no final da
inspiração = Pressão de Platô (Pplt)
2) Pela Driving Pressure (Pplt –
PEEP)
3) Pela Pressão Transpulmonar
aferida no final da inspiração ou fase de platô (PTPplt)
Por essa razão, usa-se como uma
das metas na estratégia protetora: Pplt <
30 cmH2O, PTPplt < 25 cmH2O ou DP <15cmH20; para prevenir a lesão
pulmonar induzida pela ventilação mecânica.
MONITORIZAÇÃO DA VENTILAÇÃO ESPONTÂNEA:
Quando o paciente apresenta drive
respiratório o processo torna-se complexo.
Em primeiro lugar, porque a
adição de esforço respiratório espontâneo do paciente (drive) à ventilação
mecânica envolve uma deflexão negativa, reflexo da pressão pleural (Ppl - ) gerada
pelo esforço inspiratório do paciente, combinada com uma deflexão positiva na via
aérea (Pva + ), gerada pela insuflação mecânica de ar, que resulta em um aumento aditivo na pressão
de distensão melhor avaliada pela pressão transpulmonar [PTP= Pva – (-Ppl) = Pva + Ppl].
Portanto, neste cenário confiar apenas na Pplt não seria suficiente para
avaliar a pressão de distensão alveolar e dessa forma limitar o dano. Em vez
disso, a PTP resulta numa forma melhor para avaliar a pressão de distensão
alveolar, usando a pressão esofágica (Pes) para avaliar a intensidade do
esforço, ou seja, a Ppl ou deflexão negativa (ou “swing”). Em segundo lugar, o esforço espontâneo exerce seu impacto
diferentemente nas áreas de pulmão não dependente e nas áreas de pulmão
dependente. A PTP na fase de platô (PTPplt) está associada ao estiramento
máximo do pulmão não dependente, mas não do pulmão dependente. Na fase de pico
da PTP (durante a inspiração com fluxo diferente de 0), no momento em que a Pes
é mais negativa como resultado de esforço vigoroso, a PTP de pico (PTPpi) correlata
pode corresponder também ao momento de distensão alveolar máxima da região
dependente. Portanto, em contraste com a ventilação mecânica, a PTPplt (ou
seja, no final de inspiração) potencialmente subestima o estresse pulmonar
/estiramento máximo das regiões dependentes durante esforço vigoroso em
pacientes SARA sob ventilação mecânica. Em
terceiro lugar, o esforço vigoroso parece aumentar a lesão no pulmão
dependente - a mesma região em que o esforço aumenta a distensão inspiratória. O
mecanismo chave desta lesão pelo esforço respiratório é a transmissão de
pressão heterogênea na presença de pulmão lesionado “sólido”. A deflexão
negativa da Ppl resultante da contração do diafragma é mal transmitida para o
restante da superfície pleural, e, portanto, ao pulmão dependente “confinado”
(atelectasiado). Quanto maior a pressão de distensão no pulmão haverá também
uma tendência a deslocar ar da região de pulmão não-dependente (isto é chamado
de efeito pendelluft), ou da traqueia e ventilador, em direção ao pulmão
dependente. Isso causa uma hiperdistensão transitória e recrutamento tidal
(recrutamento gerado pelo volume corrente) no pulmão dependente durante a
inspiração (isto é, na fase de pico da PTP), correspondendo, no espaço e no
tempo, à intensidade máxima da contração do diafragma e o valor negativo máximo
de pico de deflexão da Pes (swing). Importante que, tal inflação lesiva é
provavelmente observada na presença de esforço, no tecido pulmonar atelectasiado
“sólido” devido a PEEP insuficiente. Seriam estas as bases fisiopatológicas da
Lesão Pulmonar Induzida pelo Esforço Respiratório em pacientes em ventilação
mecânica.
Fig. 1 (A) Padrão de Ventilação Mecânica (B) Padrão de Ventilação Espontânea.
IMPLICAÇÕES CLÍNICAS:
Limitações do VC (6ml/kg) e Pva (Pplt
<30cmH20) são abordagens clinicamente validadas para diminuir a lesão
pulmonar induzida pela VM (estratégia protetora), mas a lesão pulmonar induzida
pelo esforço respiratório é não prevenível usando esses parâmetros globais. Em
vez disso, a monitorização da PTP, usando a Pes como reflexo da Ppl, pode ser preferível durante as ventilações
espontâneas, especialmente quando ocorre esforço inspiratório vigoroso. Neste
cenário, a PTPplt (no final da inspiração) corresponde ao tempo de distensão
máxima no pulmão não dependente, mas isso nem sempre é um bom substituto para
avaliar o estresse pulmonar do pulmão dependente. A PTPpi máxima ocorre no
momento em que a Pes é mais negativa como resultado de um esforço inspiratório vigoroso
(mesmo com fluxo inspiratório residual). Importante notar que a PTPpi pode
corresponder ao momento de máxima distensão do pulmão dependente - a região de
maior risco durante o esforço espontâneo. Assim, a limitação de PTPpi, bem como
da PTPplt pode se tornar um importante alvo na prevenção de lesões pulmonares induzidas
pelo esforço respiratório de paciente em ventilação mecânica.
No futuro, poderíamos avaliar
cuidadosamente o limite superior e seguro da PTP (ou ΔPTP) calculado por
manometria de balão esofágico a fim de minimizar a lesão pulmonar dependente do
esforço respiratório. Em primeiro lugar, a avaliação usando Pes (ΔPTP ou PTP) poderia
revelar a verdadeira PTP do pulmão dependente. Em segundo lugar, monitorando o
grau de “swing” da Pes (ou seja, intensidade de esforço respiratório espontâneo)
pode facilitar o equilíbrio entre a atrofia do diafragma (por falta de esforço)
e lesão por uso excessivo (esforço excessivo), impedindo assim a indução de disfunção
do diafragma em ambos sentidos. Em terceiro lugar, Pes é útil para monitorar assincronia
paciente-ventilador e estimar a pressões de distensão, que são potencialmente
relacionadas à lesão pulmonar induzida pelo esforço respiratório. Finalmente,
embora medições regionais de pressão são de crescente interesse, elas podem, em
última análise, ser melhor avaliados em conjunto com imagens pulmonares
regionais em tempo real.
CONCLUSÃO:
Perspectivas emergentes sobre a
fisiopatologia da Lesão Pulmonar Induzida pelo Esforço Respiratório durante a
ventilação mecânica pode ser melhor compreendida com monitoramento da Pes a
beira leito usando manometria esofágica. Estudos subsequentes deverão determinar
a validade e identificar limites para titulação da PTPpi e PTPplt, encontrando níveis
de segurança, bem como oscilações na Pes, visando uma estratégia protetora
tanto pulmonar quando diafragmática dos pacientes com SARA.
[1]
Cruz FF, Ball L, Rocco PRM, Pelosi P. Ventilator-induced lung injury during
controlled ventilation in patients with acute respiratory distress syndrome:
less is probably better. Expert Rev Respir Med. 2018 May;12(5):403-414. doi:
10.1080/17476348.2018.1457954. Epub 2018 Mar 29.
[2]
Brochard L. Ventilation-induced lung injury exists in spontaneously breathing
patients with acute respiratory failure: Yes. Intensive Care Med. 2017
Feb;43(2):250-252. doi: 10.1007/s00134-016-4645-4. Epub 2017 Jan 10.
[3] Antonelli M. Ventilation-induced lung injury
exists in spontaneously breathing patients with acute respiratory failure: No. Intensive
Care Med. 2017 Feb;43(2):253-255. doi: 10.1007/s00134-016-4488-z. Epub 2017 Jan
10.
[4]
Gattinoni L. Ventilation-induced lung injury exists in spontaneously breathing
patients with acute respiratory failure: We are not sure. Intensive Care Med
2017. Feb; 43(2): 256–258. doi: 10.1007/s00134-016-4645-4
[5]
Takeshi Yoshida, Marcelo B. P. Amato and Brian P. Kavanagh. Understanding
spontaneous vs. ventilator breaths: impact and monitoring. Intensive Care Med. Mar.
24. https://doi.org/10.1007/s00134-018-5145-5

