VENTILAÇÃO NA POSIÇÃO PRONA E AUTO-PRONA
Elaborador por: Dr. Alejandro Enrique Barba Rodas. Médico Especialista em Medicina Intensiva. Coordenador da Unidade Coronariana da Santa Casa de São Jose dos Campos - SP.
Coordenador do Programa de Residencia Médica - COREME - da Santa Casa de São Jose dos Campos - SP
1. INTRODUÇÃO
A ventilação prona refere-se à estratégia de
ventilação mecânica com o paciente deitado na posição de decúbito ventral. Entre
as várias opções terapêuticas em terapia respiratória intensiva, a posição
prona é o melhor exemplo da progressiva integração, de observações
experimentais e clínicas, entendimento fisiopatológico e de ensaios clínicos
randomizados. De fato, a história da posição prona representa um paradigma
ideal que deve ser seguido quando uma nova intervenção é proposta: a ideia foi bem
pensada e descrita, aplicada experimentalmente, discutida, refinada e finalmente
testada em ensaios clínicos progressivos até encontrar seu lugar definitivo no
arsenal terapêutico. Nós agora sabemos como, quando e por que os pacientes
devem ser pronados.
Fisiologicamente, a respiração tranquila e normal é
realizada:
(1) pelos movimentos de subida e descida do
diafragma para aumentar ou diminuir a cavidade torácica (principal); e
(2) pela elevação e depressão da grade costal que
eleva e reduz o diâmetro anteroposterior da cavidade torácica.
Durante a inspiração normal, a contração
diafragmática puxa as superfícies inferiores dos pulmões para baixo. Os
músculos mais importantes que elevam a caixa torácica (músculos inspiratórios)
são os intercostais externos, mas outros que auxiliam são (1) músculos
esternocleidomastóideos, que elevam o esterno; (2) serráteis anteriores,
que elevam as costelas; e (3) escalenos, que elevam as duas primeiras costelas.
Ao ser elevada expandem-se os pulmões porque, na posição de repouso natural, as
costelas se inclinam para baixo, possibilitando, dessa forma, que o esterno
recue em direção à coluna vertebral. As costelas durante a expiração estão
anguladas para baixo, e os intercostais externos estão alongados anterior e
inferiormente. Conforme eles se contraem, puxam as costelas superiores para
frente com relação às inferiores, o que causa mecanismo de alavanca nas
costelas, para levantá-las, produzindo a inspiração. Quando a caixa torácica é
elevada, as costelas se projetam quase diretamente para frente, fazendo com que
o esterno também se mova anteriormente para longe da coluna, aumentando o
diâmetro anteroposterior do tórax por cerca de 20% durante a inspiração máxima,
em comparação à expiração.
Durante a expiração normal, o diafragma
simplesmente relaxa, e a retração elástica dos pulmões, da parede torácica e
das estruturas abdominais comprime os pulmões e expele o ar. Os músculos que puxam
a caixa torácica para baixo, durante a expiração (músculos expiratórios), são
principalmente o (1) reto abdominal, que exerce o efeito poderoso de puxar
para baixo as costelas inferiores, ao mesmo tempo em que, em conjunto com
outros músculos abdominais, também comprime o conteúdo abdominal para cima
contra o diafragma; e (2) os intercostais internos. Os intercostais
internos funcionam exatamente de modo oposto aos externos, atuando como
músculos expiratórios, porque se angulam entre as costelas, na direção
contrária, e produzem a alavanca oposta. Durante a expiração vigorosa, no
entanto, as forças elásticas não são poderosas o suficiente para produzir a
rápida expiração necessária; assim, força extra é obtida, principalmente, pela
contração da musculatura abdominal, que empurra o conteúdo abdominal para cima,
contra a parte inferior do diafragma, comprimindo, dessa maneira, os pulmões.
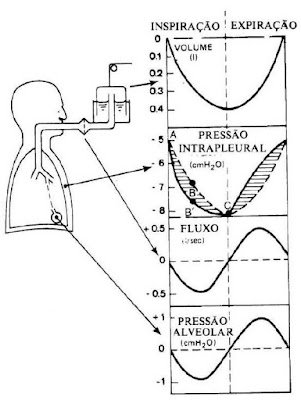
A pressão pleural (Ppl) normal no início da
inspiração (fase de repouso no final da expiração) é cerca de −5 cmH2O, que é a
quantidade de pressão necessária para manter os alvéolos abertos. A Pressão
pleural (Ppl) de repouso negativa (-5 cmH2O) resulta do equilíbrio entre a
força de sucção exercida para grade costal que tende a expandir a caixa
torácica e a pressão de retração pulmonar que em sentido contrário representa as
forças elásticas nos pulmões que tendem a colapsá-los (Figura 1).
Figura 1: Pressão Intrapelural
A pressão alveolar (Ppl) é a pressão dentro dos alvéolos
e cujo valor muda a depender da fase do ciclo respiratório.
A Pressão Transpulmonar (PTP) é a diferença
entre a pressão alveolar (Palv) – a pressão pleural (Ppl), que representa a pressão de
expansão dos alvéolos.
Quando a glote está aberta e não existe fluxo de ar
para dentro ou para fora dos pulmões, as pressões em todas as partes da árvore respiratória,
até os alvéolos, são iguais à pressão atmosférica, que é considerada a pressão
de referência zero nas vias aéreas — isto é, 0 cmH2O (pressão de repouso). Para
causar o influxo de ar para os alvéolos, durante a inspiração a pressão alveolar
(Palv) deve cair para valor ligeiramente abaixo da pressão atmosférica (abaixo
de 0), cerca de −1 cmH2O. Essa pressão ligeiramente negativa é suficiente para
puxar 0,5 litro de ar para o interior dos pulmões, nos 2 segundos necessários
para uma inspiração normal e tranquila.
Durante a expiração, a pressão alveolar sobe para
cerca de +1 centímetro de água e força o 0,5 litro de ar inspirado para fora
dos pulmões, durante os 2 a 3 segundos de expiração.
No início da inspiração normal: Palv =0cmH2O; Ppl=
-5cmH2O e PTP = +5cmH2O (0 - -5cmH2O). A expansão da caixa torácica traciona
os pulmões para diante com força maior e cria uma Ppl mais negativa, que chega
a cerca de −7,5 cmH2O. Ao longo da inspiração a PTP irá aumentando (Figura 2).
Figura 2: Variação da Pressão Transpulmonar (PTP)
Qualquer que seja o posicionamento de um indivíduo,
a expansão alveolar sempre dependerá da pressão transpulmonar (PTP).
Anatomicamente as bases pulmonares possuem uma
maior área de tecido pulmonar (alvéolos e vasos sanguíneos) que os ápices pulmonares.
Assim fisiologicamente as bases pulmonares são mais ventiladas e perfundidas. O
efeito da gravidade ainda, faz com que o fluxo sanguíneo tenda a se dirigir com
maior intensidade para as bases aumentando o peso destas regiões, que são por
essas razões, denominadas de “áreas dependentes”, tornando os ápices “áreas
não dependentes”. O maior peso pulmonar (que pode ainda, ser aumentado por
edema intersticial) representam uma força opositora à pressão negativa pleural
e uma força compressiva sobre os alvéolos. Assim, por estas razões, nas bases
pulmonares a pressão pleural é menos negativa que nos ápices pulmonares e os alvéolos
destas bases pulmonares estarão menos distendidos (alvéolos mais complacentes e
recrutáveis) que nos ápices (mais distendidos, menos complacentes e
recrutáveis). Na posição supina, ocorrem fenômenos semelhantes com a diferença que
teremos áreas dependentes posteriores e áreas não dependentes anteriores (Figura
3).
Figura 3: Pressão Pleural
3. EFEITOS
DA POSIÇÃO PRONA NA MECÂNICA RESPIRATÓRIA E NA OXIGENAÇÃO[3] [4]
[5]
[6]
[7]
[8]
[9]
[10]
[11]
[12]
[13].
A posição prona altera a mecânica e a fisiologia da
troca de gases melhorando a oxigenação que resulta em redução da mortalidade em
uma população selecionada de pacientes com Síndrome de Angústia Respiratória do
Adulto (S.A.R.A). Essa melhora da oxigenação pode ser atribuída a vários
mecanismos que podem ocorrer de forma isolada ou associados. Dentre eles, estão a diminuição dos fatores
que contribuem para o colabamento alveolar: a redistribuição da ventilação
alveolar e a redistribuição da perfusão.
a) Peso pulmonar. o edema pulmonar faz o peso
pulmonar aumentar, o que, somado à ação da gravidade, faz com que as regiões dependentes
sofram colapso (atelectasia compressiva). Desta maneira, em posição supina, a
região dorsal é a mais colapsada pelo acúmulo de líquido intersticial. Ao se
pronar o doente, o edema da região dorsal se desloca para a região ventral (“modelo
da esponja” de Bone RC) não sofrendo mais ação do peso pulmonar, de modo que se
torna mais expandida que pode ser assim mantida por efeito da PEEP associada
(pressão sobreposta). Quando um paciente está em decúbito dorsal, a PTP ventral
excede significativamente a PTP dorsal, resultando em maior expansão dos
alvéolos ventrais do que os alvéolos dorsais; esse efeito é exagerado na
síndrome da angústia respiratória aguda (SARA), de modo que os alvéolos
ventrais se tornam excessivamente distendidos e os alvéolos dorsais se tornam
atelectasiados. A posição prona reduz a diferença entre o PTP dorsal e ventral,
tornando a ventilação mais homogênea, levando a uma diminuição da hiperinflação
alveolar ventral e colapso alveolar dorsal e recrutamento de alvéolos que
entraram em colapso durante a ventilação supina. Na SARA, existe importante alteração
da relação ventilação/perfusão na posição supina, uma vez que o fluxo sanguíneo
e o colapso alveolar são maiores nas porções dependentes do pulmão. Em prona, a
relação ventilação/perfusão melhora, pois o pulmão anteriormente dependente
continua a receber a maior parte do fluxo sanguíneo à medida que os alvéolos
reabrem, enquanto o pulmão recém-dependente continua a receber a minoria do
fluxo sanguíneo à medida que os alvéolos começam a colapsar (Figuras 4 e 5).
Figura 4: Melhora da atelectasia com a
posição prona
Figura 5: Imagem na TC dos efeitos da
posição prona
A posição prona torna a razão ar/tecido mais
homogênea quando comparada à posição supina, e isso acontece tanto em
indivíduos normais quanto pacientes com SARA: uma distribuição mais homogênea das
áreas de densidade implica que as pressões transpulmonares também são
distribuídas de maneira mais homogênea na posição prona do que na posição
supina. De fato, na posição supina, as áreas pulmonares não dependentes
(ventrais ou anteriores) estão mais distendidas que as dependentes (dorsais ou
posteriores), e essas diferenças são significativamente reduzidas quando a
posição prona é aplicada. Os mecanismos através do qual isso acontece
provavelmente estão relacionados à necessidade de o pulmão adaptar sua forma à
caixa torácica. Por exemplo, quanto mais "triangular" é a forma da
área de pulmão não dependente dentro de uma da caixa torácica mais “esférica”,
maior o alongamento para alinhamento dessas duas estruturas. Isso descreve o mecanismo
denominado “incompatibilidade das formas". Segundo este mecanismo, o
pulmão isolado pode ser pensado como um cone, com unidades alveolares do mesmo
tamanho em todo o parênquima se não houver efeito da gravidade. Quando o pulmão
é colocado na caixa torácica, a necessidade do cone se adaptar a uma forma mais
cilíndrica da caixa torácica impõe uma força de alongamento no ápice do cone, o
que leva a um aumento no tamanho das unidades alveolares nessa área. A consequência
é uma maior expansão das regiões ventrais comparadas às dorsais. Entretanto,
esse mecanismo está ligado às forças gravitacionais (peso pulmonar), que
atuam comprimindo progressivamente as unidades pulmonares ao longo do eixo
gravitacional (não dependente à dependente). Quando a
gravidade é adicionada, as unidades na parte inferior do pulmão sentem a
pressão sobreposta das unidades da parte superior e tendem a entrar em colapso.
Portanto, na posição supina, a incompatibilidade das formas e a força gravitacional
agem na mesma direção (expansão das unidades pulmonares não dependentes e
compressão das dependentes). Esses dois fenômenos provocam falta de
homogeneidade na ventilação nos pulmões normais e na SARA. Na posição prona, a incompatibilidade
das formas e a força gravitacional agem em direções opostas: enquanto pela
incompatibilidade das formas há tendência a expandir as regiões ventrais, a
força gravitacional (peso pulmonar) tende a comprimi-las (Figura 6). O resultado
é que a ventilação das unidades pulmonares dependentes e não dependentes são mais
homogêneas na posição prona. As consequências dessa maior homogeneidade são
evidentes: ventilação e perfusão são distribuídas de maneira mais homogênea levando
a uma melhoria da oxigenação, qualquer dano eventualmente provocado pela carga
de energia da ventilação mecânica ficará mais uniformemente distribuída no
parênquima pulmonar na posição prona do que na posição supina.
Figura 6: Mecanismo de incompatibilidade das formas e o efeito gravitacional
Também tem sido proposta uma melhora na capacidade
residual funcional aumentada (CRF), mas alterações na CRF não foram um achado
dominante na maioria dos estudos de ventilação prona. Alterações na
distribuição da água e secreções extravasculares do pulmão também podem
desempenhar um papel.
b) Massa cardíaca. Em indivíduos normais, o peso do
coração sobre regiões dependentes do pulmão diminui o gradiente de pressão
transpulmonar, o que facilita o seu colabamento. Nos pacientes com SARA, este
efeito pode ser ainda mais acentuado, devido ao aumento da câmara cardíaca
direita secundária à hipertensão pulmonar decorrente da vasoconstrição
hipóxica, liberação de substâncias vasoconstritoras e remodelamento da
circulação pulmonar. Estudos tomográficos em posições prona e supina compararam
as áreas pulmonares que estavam sob compressão cardíaca e mostraram que ao
contrário da posição supina, que tinha considerável fração de ambos pulmões sob
peso cardíaco, na posição prona apenas uma pequena fração de ambos pulmões
estava sob este efeito.
c) Alteração da mobilidade diafragmática e desvio
cefálico do conteúdo abdominal. Em humanos, o movimento do diafragma na posição supina
é uniforme enquanto que na posição prona ocorre maior movimentação da região
dorsal. Este fato ocorre porque, provavelmente, a compressão do diafragma pelos
órgãos abdominais se torna menor. A sedação e a paralisia dos pacientes ventilados
mecanicamente deprimem o tônus muscular diafragmático, fazendo com que o
conteúdo abdominal induza a um desvio cefálico das regiões mais posteriores do
diafragma em posição supina, o que contribui para o colapso destas regiões. Em
posição prona, o peso do conteúdo abdominal fica repousado sobre a superfície
do leito, diminuindo o desvio do diafragma.
d) Configuração da caixa torácica. A configuração da caixa torácica
pode influenciar na pressão transpulmonar das diferentes regiões pulmonares. Na
posição supina seu formato é triangular (ápice em cima), o que permite a
formação de atelectasias mais extensas na região dorsal. Na posição prona ela
assume uma forma mais retangular, de modo que a formação de atelectasias se
torna menor.
e) Redistribuição da perfusão
A explicação de que a melhoria da oxigenação com a
posição prona deva-se ao recrutamento pulmonar não é completamente verdadeira.
Na verdade, a abertura observada nas regiões dorsais na posição prona está
sempre associada ao colabamento parcial das regiões ventrais. De fato, a média
das densidades na tomografia computadorizada não mudam significativamente com a
posição. Portanto, o que realmente parece explicar o efeito observado é a
diferença entre o recrutamento dorsal e o des-recrutamento ventral do pulmão.
Essa diferença está estreitamente relacionada às mudanças na fração de shunt e
de perfusão que tem sido observado. O papel da forma do pulmão é bastante óbvio
se pensarmos no “modelo da esponja”. Imagine-se que o peso do pulmão é aumentado
para uma quantidade tal que cause o colabamento das regiões pulmonares dorsais em
50% da altura pulmonar: devido às forças compressivas relacionadas ao peso
quando o paciente está
pronado, o pulmão entra em colapso a 50% da sua
altura (a região ventral) enquanto o ouro 50% (regiões dorsais) reabrirá. O
efeito nas trocas gasosas dependerá da quantidade de massa presente no 50%
superior e 50% inferior. Se os pulmões fossem perfeitamente redondos, a
quantidade de massa seria exatamente a mesma na parte superior e inferior. No
entanto, como a forma é quase cônica (com o ápice voltado para a parte ventral
do tórax), maior quantidade de massa pulmonar estará presente nos 50% dorsais,
e reabrirá na posição prona associada a uma maior rede de vasos sanguíneos perfundindo
essa região aberta o que favorecerá também uma melhor perfusão (Figura 7).
Figura 7: Redistribuição da perfusão na posição prona
f) Complacência Pulmonar
Na posição supina, a complacência da parede
torácica é determinada pela elasticidade relativa da parede torácica anterior e
do diafragma, uma vez que a porção posterior do tórax está em contato com a
cama reduzindo sua capacidade de expansibilidade. Na posição prona, a elasticidade
geral do diafragma não muda, enquanto a parte dorsal do tórax fica livre para
se mover. Devido à conformação anatômica do tórax, a parede torácica dorsal é
menos complacente que o anterior; portanto, a complacência líquida da parede
torácica diminui em um paciente em posição prona. Esta situação contrariamente
ao que possa se pensar, favorece uma melhor distribuição de gases em direção às
regiões pulmonares ventrais e paradiafragmática, com um maior recrutamento
dessas áreas. Daqui resulta que a distribuição de ar se torna mais homogênea. As
alterações na complacência geral da parede torácica durante a posição prona,
explica por que essa manobra está associada a um aumento na capacidade de
recrutamento pulmonar. A resposta da mecânica do sistema respiratório à posição
prona seria um aumento na pressão das vias aéreas durante a ventilação controlada
a volume (VCV) ou uma diminuição do volume corrente (VC) durante a ventilação
controlada a pressão (PCV). Na verdade, após a manobra, a pressão do platô pode
não aumentar, mas pode permanecer constante ou até diminuir fortemente: isso sugere
um recrutamento líquido do pulmão durante a VCV. Por outro lado, durante a PCV,
se a posição prona estiver associada a um recrutamento pulmonar líquido, o
volume corrente permaneceria constante ou até aumentaria.
g) Liberação de CO2
A PaCO2 durante a posição prona pode permanecer inalterada,
aumentar ou até diminuir, dependendo do comportamento da ventilação alveolar e
sua relação com o volume pulmonar total (isto é, com capacidade de recrutamento
pulmonar líquida). Um aumento de PaCO2 na posição prona pode depender de dois
mecanismos diferentes a seguir:
• Diminuição da ventilação alveolar (unidades
alveolares hiperinsufladas têm uma complacência menor e, portanto, são menos ventiladas.
A menos da complacência da parede torácica posterior também pode ser responsável
por uma diminuição do volume alveolar.
• Uma mudança relativa na perfusão pulmonar.
Por outro lado, embora se tenha verificado uma
diminuição da PaCO2 relacionados a um aumento líquido na capacidade de
recrutamento, o aumento da PaO2 não parece depender totalmente desse efeito: a
oxigenação pode de fato, melhorar por outras causas além da capacidade de
recrutamento. Em geral, uma diminuição na PaCO2 significa uma diminuição no
espaço morto. Interessante notar que o espaço morto fisiológico, como calculado
por métodos padrão, inclui não apenas o espaço morto real, mas também, em
parte, o componente da fração shunt, que aumenta as diferenças entre o PCO2 alveolar
e arterial. Portanto, o espaço morto reflete o comportamento das trocas gasosas
respiratórias, e isso pode explicar por que essa é uma das variáveis mais
associadas ao resultado final.
4. CONTEXTO
ATUAL DE USO
4.1. EM
PACIENTES EM VENTILAÇÃO MECÂNICA
Em 2013, o estudo PROSEVA (TRIAL) de Claude
Guerin et.al.,
publicado na revista NEJM mostrou que a ventilação mecânica em posição prona melhorava
a sobrevida do paciente em SARA grave. O estudo definia SARA grave pela relação
Pa02/Fi02 < 150 mmHg, com uma Fi02 de pelo menos 60% (0.6), uma PEEP ≥ 5 cmH20
e um VC de 6ml/kg de peso predito. A mortalidade em 28 dias foi de 16,0% no
grupo prona versus 32,8% no grupo supino (P <0,001). A taxa de risco de morte
em posição prona foi de 0,39 (IC 95%, 0,25 a 0,63). A Mortalidade não ajustada
em 90 dias foi de 23,6% no grupo prono versus 41,0% no grupo supino (P
<0,001), com uma taxa de risco de morte de 0,44 (IC 95%, 0,29 a 0,67). Esse
estudo paradigma concluiu que em pacientes com SARA grave (hoje moderada a
grave), a aplicação precoce de sessões de pelo menos 16 horas consecutivas de
posição prona (por 4 de supina) diminuiu significativamente a mortalidade em 28
e 90 dias[14].
Seu uso, entretanto, não obteve a adesão almejada, prevalecendo ainda as estratégias
a base de manobras de recrutamento alveolar (MRA). Até 2013 vários outros
estudos já haviam sido publicados sobre posição prona, com participação de
grandes pesquisadores como Gattinoni, Taccone, Pesenti, Mancebo, Fernandez e o próprio
Guerin, entre outros[15]
[16]
[17]
[18]
[19]
[20]
[21]
[22]
[23]
[24].
A metanalise desses estudos foi publicada em julho de 2014 no CMAJ, a
mesma que concluiu que o uso da posição prona durante a ventilação mecânica,
reduziu todas as causas de mortalidade de forma significativa entre os
pacientes com SARA grave (P/F <100mmHg) que receberam ventilação mecânica
protetora, mas não significativa entre os pacientes com SARA leve (P/F 100 –
199mmHg) e moderada (P/F 200 – 299mmHg)[25].
Outras metanálises obtiveram conclusões similares[26]
[27]
[28].
Entretanto uma revisão sistemática da Cochrane em 2015 não encontrou evidências
convincentes de benefício ou dano da aplicação universal da posição pronba em
adultos com hipoxemia sob ventilação mecânica em unidades de terapia intensiva
(UTI)[29].
No Brasil, as Diretrizes de Ventilação Mecânica de 2013, adotaram os critérios
e indicações do estudo PROSEVA. Metanálises em 2014 mostraram benefícios no uso
também na SARA moderada[30].
Em maio de 2017, Guerin publica uma revisão, na qual
conclui que a posição prona é um componente essencial da ventilação mecânica de
proteção pulmonar e deve ser usada como terapia de primeira linha em associação
com baixo volume corrente e agentes bloqueadores neuromusculares em pacientes
com SDRA grave[31]. Em
outubro de 2017, uma metanálise de Laveena Munshi et.al., encontrou redução
da mortalidade no subgrupo de pacientes com SARA grave ventilados mecanicamente
em posição prona quando aplicada por pelo menos 12 horas diárias[32].
Circunstancialmente, no mesmo mês de outubro de 2017, publica na revista JAMA,
o Estudo ART, um grande estudo randomizado que mostrou que uma estratégia de
manobras de recrutamento máximo com titulação PEEP mais alta (contra o padrão,
de PEEP baixa) resultou em aumento da mortalidade de 28 dias. Esses resultados
do ART, trouxe questionamentos às Manobras de Recrutamento Alveolar, voltando
uma atenção maior para a estratégia de prona com titulação de PEEP baixa
associada a estratégia protetora[33].
Em dezembro de 2017, o próprio Guerin e col., publica o estudo APRONET
(estudo prospectivo internacional de 1 dia de prevalência realizado quatro datas
em abril, Julho e outubro de 2016 e janeiro de 2017), mostrando que a taxa de
uso de posição prona foi de 5,9%
(11/187), 10,3% (41/399) e 32,9% (49/149), na SARA leve (201 -300), moderada
(101-200) e grave (≤100) respectivamente, definidas de acordo com os critérios
de Berlim e em 40,2% daqueles que cumpriam os critérios adotados no PROSEVA (PaO2/FIO2
< 150 mmHg, PEEP ≥ 5 cm H2O, FIO2 ≥ 0.60)[34].
No mesmo ano de 2017, diretrizes desenvolvidas pela ATS (American Thoracic Society), ESICM (European Society of Intensive Care Medicine) e SCCM (Society of Critical Care Medicine Clinical
Practice Guideline) foram publicadas trazendo a recomendação forte do uso
da estratégia prona para pacientes com SARA grave, definida pelos critérios de
Berlim, por pelo menos 12 horas por dia. Na ocasião, houve falta de consenso do
painel sobre o fornecimento de uma recomendação para posicionamento prona em
pacientes com SARA moderada segundo os critérios de inclusão do estudo PROSEVA (PaO2/FIO2
101-150) devido ao menor confiança no equilíbrio entre o desejável em
comparação com indesejável resultados neste subgrupo de pacientes[35].
Em fevereiro de 2019, duas importantes revisões foram publicadas na mesma revista Semin
Respir Crit Care Med pelo grupo italiano. Na primeira, de Gattinoni e
col., trazem uma atualização sobre os mecanismos por trás da posição prona,
destacando sua complexidade. De fato, os efeitos positivos na oxigenação e na
liberação de CO2 da posição prona devem ser atribuídos a uma insuflação-ventilação
mais homogênea, à incompatibilidade do formato pulmonar/torácico e à alteração
da elastância da parede torácica. O grupo faz uma revisão de cinco grandes
ensaios que tentaram, a partir de diferentes teorias, hipóteses e modelos,
demonstrar a eficácia da posição prona, que finalmente levou esta estratégia a
ocupar seu lugar definitivo entre as diferentes terapias de suporte à SDRA[36].
A segunda, uma revisão de Michele Umbrello e col., aponta que o efeito
protetor do pulmão na posição prona, pode ser ainda mais importante em
pacientes obesos por causa de diminuição da CRF e aumento da atelectasia. O
procedimento mostrou-se seguro em pacientes de centros experientes. Fisiologia
clássica aplicada em estudos realizados no final dos anos 90 em pacientes obesos
descobriram como a posição prona aumenta volume pulmonar, reduz a elastância
pulmonar e melhora a oxigenação em pacientes obesos. No entanto, os pacientes obesos
colocados em decúbito ventral, sua pressão intra-abdominal tenderá a aumentar, apresentando
maior incidência de lesão renal e hepatite hipóxica, pelo que estas funções
devem ser rigorosamente monitorizadas[37].
Técnica
São necessárias mínimo de 3 e idealmente 5 pessoas
para o posicionamento do paciente.
-Uma deverá permanecer sempre na cabeceira do leito
e será responsável pelo tubo endotraqueal. É aconselhável tenha pronta sonda de
aspiração para uso imediato, visto que ocorre abundante drenagem de secreção
após o posicionamento em prona.
-Uma segunda pessoa ficará encarregada de cuidar
para que cateteres, drenos e conexões não sejam tracionados.
-As outras pessoas, estarão posicionadas a cada
lado do leito, e serão responsáveis por virar o paciente, primeiramente para o
decúbito lateral, e em seguida para a posição prona. Os braços devem ser
posicionados ao longo do corpo, com a cabeça voltada para um dos lados, e os
eletrodos para monitorização cardíaca fixados no dorso. Não é necessário que se
faça suspensão abdominal, já que este procedimento não traz nenhuma vantagem sobre
a resposta positiva da posição.
- Deve-se manter a prona por 16 a 20 horas/dia.
Preparação
Para minimizar algumas complicações, é importante, antes
do procedimento, verificar se o tubo endotraqueal está posicionado 2 cm acima
da carina e fixado de forma segura; parar a alimentação enteral e constatar a
presença de resíduos alimentares; assegurar-se de que todos os acessos e
cateteres estão desconectados; e durante o posicionamento em prona, mudar a
posição da cabeça a cada duas a quatro horas.
- Como
terapia de resgate: precocemente (nas primeiras 48h) nos casos de SARA
grave que não melhoram apesar do uso de tais estratégias ventilatórias protetora
convencional em posição supina. Conforme o estudo PROSEVA, SARA Grave
definida como a relação P/F < 150 com FiO2 ≥0,6 e PEEP ≥5 cm H2O.
- Na
hipoxemia refratária devido a SARA: Uma definição razoável é uma
relação P/F ≤100 mmHg com PaO2 ≤60 mmHg, apesar da otimização dos ajustes
do ventilador com FiO2 de 100%.
- Na
SARA moderada (segundo definição de Berlim), quando:
- Após PEEP titulada;
- IVD (Insuficiência Ventricular Direita Aguda – Cor Pulmonale Agudo)
moderada a grave
- Na
impossibilidade de sustentar ventilação protetora: paciente com Pressão
de Distensão (Driving Pressure) > 15 cmH2O; FR > 35 rpm; pH <
7,2.
- Em
raras circunstâncias, a ventilação propensa tem sido usada como uma ponte
para a ECMO
Contraindicações
a) Absolutas:
·
Choque refratário
·
Sangramento
agudo (por exemplo, HDA, hemoptise maciça)
·
Múltiplas
fraturas ou traumas (por exemplo, fraturas instáveis do fêmur, pelve, face)
·
Instabilidade
ou risco de instabilidade da coluna vertebral (TRM, artrite reumatoide)
·
Hipertensão
intracraniana com PIC > 30 mmHg ou pressão de perfusão cerebral <60 mmHg
·
Cirurgia
traqueal ou esternotomia dentro de duas semanas
b) Relativas:
·
TVP
recente tratada por <2 dias
·
Instabilidade
hemodinâmica (PAM 65mmHg)
·
Tubo (s)
anterior (es) do tórax com vazamento de ar
·
Cirurgia
abdominal maior
·
Cirurgia
torácica
·
Via área
difícil e intubação difícil.
·
Dialise peritoneal
·
Marcapasso
recente, BIA, dispositivos de assistência ventricular
·
Arritmias
graves com risco de vida
·
Condições
clínicas que limitam a expectativa de vida (por exemplo, insuficiência
respiratória dependente de oxigênio ou ventilador)
·
Queimaduras
graves, principalmente anteriores.
·
Gravidez
no 2º/3º trimestre
·
Receptor
de transplante pulmonar
·
Uso
prévio de terapias de resgate (óxido nítrico inalado, bimesialta de almitrina,
oxigenação por membrana extracorpórea (ECMO) ou ventilação não invasiva (VNI)
antes da intubação.
·
Intolerância
previa à manobra de prona
Complicações
- Compressão
do nervo (por exemplo, lesão do plexo braquial)
- Edema
facial (melhora com trendelemburg reverso a 10º)
- Ulcerações
cutâneas (queixo, orelhas, região anterior do tórax, cristas ilíacas e
joelhos)
- Obstrução
de via aérea superior por acúmulo de secreções
- Deslocamento
do tubo endotraqueal e cateteres
- Disfunção
do diafragma (pelo uso de BNM)
- Feridas
por pressão (por exemplo, facial)
- Deslocamento
de cateteres vasculares ou tubos de drenagem
- Extubação
acidental
- Hipotensão
severa
- Arritmias
- Úlceras
de córnea
- Redução
transitória da saturação arterial de oxigênio
- Vômito
(melhora com trendelemburg reverso a 10º)
- Arritmias
transitórias
- Barotrauma
devido a intubação traqueal seletiva
4.1.2. TÉCNICA PROTOCOLIZADA:
1-
Paciente em posição supina com cabeceira a 0 grau
2-
Importante checar posição de equipos, traquéia da
prótese ventilatória, sondas (vesical e nasoentérica) e estabilidade hemodinâmica
do paciente antes do início da manobra
3-
Parar dieta antes de pronar.
4-
Sedação e analgesia profundas, com ou sem bloqueio
meuromuscular (BNM)
5-
Instituir acesso venoso central e monitorização
contínua de pressão arterial invasiva.
6-
Fi02 100%. Dar preferência ao movo ventilatório volume
controlado (VCV)
7-
Posicionar as mãos do paciente embaixo da região glútea
com a palma da mão voltada para baixo com devida proteção ocular (manter olhos
fechados)
8-
Colocar coxins na frente do paciente distribuídos de
modo a aliviar os pontos de apoio anatômicos principais (usar o KIT prona, se
disponível). Colocar os coxins na cintura pélvica e escapular para alivio da
compressão sobre o abdome. Deve-se usar proteção para testa, face, joelhos e
ombros (placas hidrocolóides). Considerar colocar uma fralda absorvente na face
do paciente. Trocar se muito úmido
9-
Cobrir paciente
com lençol cujas bordas laterais devem ser enroladas com as bordas do lençol
onde o paciente está deitado, na forma de envelopamento que deve se manter firme
para uma melhor mobilização do paciente.
10- Movimentar
paciente em bloco com devida comunicação da equipe em 3 tempos (horizontal
-> decubito lateral com corpo para acima - > prona). Médico dirige os tempos
dos movimentos na contagem de “1-2-3”. As pessoas que se encontram na parte
lateral da cama deverão se posicionar de forma firme e estável (um passo na
frente e outro atrás) usando o próprio corpo para evitar o risco de caída do
corpo do paciente.
11- Ajeitar a roupa de cama do paciente, posição
de cateteres, e eletrodos no dorso do paciente.
12- Posição
da cabeça deve ser alternada com troca de posição de 2/2h (posição de
“nadador”).
13- Reiniciar
dieta enteral com volume menor. Pode se manter o paciente em leve trendelemburg
reverso para reduzir risco de vomito.
14- Certificar-se
de que os olhos estão fechados
15- Monitorar
resposta à prona com SpO2. Se houver dessaturação abaixo de 90% mantida após 10
minutos da rotação, retornar para supina.
16- Retornar
a posição supina se PCR, piora hemodinâmica grave, arritmias malignas ou
suspeita de deslocamento da prótese ventilatória
17- Coletar
gasometria após 1 hora de prona. Considerar o paciente como respondedor se a
P/F aumentar em 20% ou PaO2 aumentar em 10mm Hg.
18- Manutenção
da posição prona por 16 a 20 horas/dia.
4.1.3 VIDEOS ILUSTRATIVOS
4.2.
EM PACIENTES EM VENTILAÇÃO ESPONTÂNEA COM COVID-19
Em
2015, Scaravilli e col., publicou uma série de casos retrospectivos de
15 pacientes com insuficiência respiratória hipoxêmica, submetidos a pronação
em ventilação espontânea (não intubados). Em geral, a maioria dos pacientes
apresentava pneumonia (13/15), eram imunocomprometidos (8/15), não necessitaram
de intubação (13/15) e sobreviveram (12/15). Pronação foi realizada 43 vezes, representando
uma média de duas vezes por paciente aproximadamente. Na maioria das vezes, o
oxigênio era fornecido com uma máscara facial, máscara de BiPAP ou Capacete de
CPAP (helmet). Tempo de pronação foi mínimo de 3 horas e máximo de 8 horas.
Durante 18 procedimentos de pronação, o paciente foi mantido com a mesma quantidade
de suporte respiratório durante todo o procedimento. A posição prona melhorou a
oxigenação transitoriamente, mas depois diminuiu para a linha de base. Pronação
não teve efeitos sobre a PaCO2, pH, frequência respiratória ou hemodinâmica.
Dois procedimentos de pronação foram interrompidos devido à intolerância do
paciente, mas nenhuma complicação foi observada. Este estudo tem sua limitado
pelo seu desenho retrospectivo. Em particular, não está claro quais critérios
de seleção foram usados para determinar quais pacientes foram submetidos a
pronação. No entanto, medir os pontos temporais em série no curso de cada
paciente permitiu que cada paciente sirva como seu próprio controle interno[44].
Normalmente,
a posição prona é usada em pacientes intubados sob ventilação mecânica. No
entanto, a fisiologia da pronação deve funcionar independentemente do tipo de
ventilação (espontânea ou mecânica). Isto porque existem benefícios com a
ventilação espontânea, como uma melhor depuração da secreção (a gravidade funciona
a seu favor), o recrutamento de regiões posteriores do pulmão (dependentes) que
frequentemente se tornam atelectáticas, melhor relação ventilação/perfusão. Pelo
estudo de Scaravilli e col., o comportamento da curva de oxigenação em
pacientes em ventilação espontânea foi similar ao dos pacientes em ventilação
mecânica, sugerindo provavelmente a mesma fisiologia. Ainda, não estava claro
se o paciente poderia tolerar períodos prolongados como preconizados para
pacientes ventilados mecanicamente (pelo menos 16 horas, porém, mesmo que os
pacientes não intubados não tolerassem tais períodos prolongados, algumas horas
de pronação poderiam ser suficientes para recrutar as bases pulmonares. Os
benefícios da pronação são inquestionáveis, já que poderia evitar a intubação e
os riscos e efeitos deletérios da ventilação mecânica (VILI), sedação e uso de
bloqueador neuromuscular, além de eventualmente evitar uma ocupação de leito de
UTI. O principal risco de pronar paciente acordado em ventilação espontânea pode
ser o atraso da intubação e piora clínica e da hipoxemia, aumentando o risco de
dessaturação durante a intubação. Assim e pronação em pacientes acordados e em
ventilação espontânea poderia ser considerada nas seguintes condições[45]:
(1)
Insuficiência respiratória hipoxêmica (tipo I) isolada sem dispneia severa (paciente
hipoxêmico com "aparência paradoxalmente bem"). Deve atender aos
seguintes critérios:
·
sem falência de múltiplos órgãos
·
expectativa de que o paciente tenha uma lesão
pulmonar bastante reversível e possa evitar intubação
·
sem hipercapnia ou dispnéia severa
·
estado mental normal, capaz de comunicar
angústia ou desconforto
·
ausência de critérios de via aérea difícil
(2)
Pacientes que manifestam “desejo de não ser intubados” (DNI). O principal risco
de pronar acordado é que ele pode causar propositalmente atrasos excessivos e
desnecessários da intubação. No paciente com DNI que está falhando com outros
modos de ventilação, há pouco a perder com o teste de pronação acordada.
(3)
Isso pode ser tentado como uma medida temporária para um paciente hipoxêmico, quando
a intubação não estiver disponível imediatamente (por exemplo, dessaturação
durante o transporte). Muitos pacientes acordados são capazes de se pronunciar,
portanto isso pode ser possível sem outros recursos.
Após
a publicação de Scaravilli e col. em 2015, não se sucederam novas publicações
sobre o assunto caindo praticamente no esquecimento.
Entretanto,
em 30.01.2020, Lin Ding e col. publicam no Critical Care, um
estudo de coorte, multicêntrico, observacional e prospectivo realizado entre
janeiro de 2018 e abril de 2019, para avaliar se o uso precoce de posição prona
(PP) em paciente acordado e em ventilação espontânea, associada ventilação não
invasiva (VNI) ou cânula nasal de alto fluxo (CNAF) poderia evitar a
necessidade de intubação em pacientes com SARA moderada a grave. A eficácia da
estratégia na melhoria da oxigenação foi testada em quatro grupos de pacientes:
CNAF, CNAF + PP, VNI, VNI + PP. O desfecho primário foi a taxa de intubação. Os
pacientes foram inicialmente colocados na VNI (CPAP/BiPAP) com PEEP de 5cmH20 e
Fi02 inicial de 50% por pelo menos 30 minutos, visando como meta uma Sa02 ≥90%
com Fi02 ≤ 60%. Caso a Sa02 < 90% após o teste inicial com VNI o
paciente era colocado em posição prona, mantendo a VNI. Caso atingisse a meta,
era colocado em CNAF sendo que se apresentava dessaturação < 90% era também colocado
na posição prona mantendo a CNAF. A duração média do PP foi de 2 h duas
vezes ao dia. Um total de 20 pacientes com SARA foram incluídos. As
principais causas de SARA foram pneumonia por influenza (9 casos, 45%) e outros
vírus (2 casos, 10%). Dez casos eram SARA
moderada e 10 casos eram graves. 11 pacientes evitaram a intubação (grupo de
sucesso) e 9 pacientes foram intubados (grupo de falha). Todos os 7 pacientes
com PaO2/FiO2<100 mmHg na VNI necessitaram de intubação. A PaO2/FiO2 em HFNC
+ PP foi significativamente maior no grupo de sucesso do que no grupo de falha
(125 ± 41 mmHg vs 119 ± 19 mmHg, P = 0,043). A PaO2 / FiO2 demonstrou uma
tendência ascendente nos pacientes de todos os grupos. O estudo concluiu que, a
aplicação precoce de PP com HFNC, especialmente em pacientes com SARA moderada
e SpO2 basal > 95%, pode ajudar a evitar a intubação. O PP foi bem tolerado,
e a eficácia na PaO2/FiO2 das quatro estratégias de suporte foi: CNAF < CNAF
+ PP ≤ VNI < VNI + PP. Pacientes com SARA grave não eram candidatos
adequados para HFNC/VNI + PP[46].
Em
2020, a situação de pandemia provocada pelo SARS-Cov-19, provocando quadros
graves associados a insuficiência respiratória aguda, motivo inicialmente a
recomendação de intubação precoce nesses pacientes. Ainda o risco de aerossolização
de certos procedimentos como oxigenação com alto fluxo, ventilação não invasiva
e nebulização, gerou muita controvérsia nas recomendações desses procedimentos,
a despeito da sua já comprovada utilidade nos casos de insuficiência respiratória
tipo I ou hipoxêmica, como são, em regra, os casos provocados pelo COVID-19.
Em
contrapartida, a necessidade de buscar alternativas, que pudessem evitar a
intubação e os riscos e efeitos deletérios da ventilação mecânica (VILI),
sedação e uso de bloqueador neuromuscular, além de eventualmente evitar uma
ocupação de leito de UTI deixando-o reservado para aqueles casos inevitáveis,
levou a resgatar a posição prona em paciente em ventilação espontânea e
acordado. Durante a pandemia alguns poucos estudos têm sido publicados a
respeito assim como protocolos têm sido propostos, sem, no entanto, ainda,
baseados em estudos de forte nível de evidência.
O
artigo de Qin Sun e col., pode ser o primeiro em reconhecer o valor da
pronação precoce em paciente acordado com COVID-19 como um método para evitar o
colapso alveolar. Esses autores descreveram uma estratégia de tratamento empregada
em seu centro (província de Jiangsu, China) de que se correlacionou com taxas
de intubação e mortalidade consideravelmente mais baixas do que as observadas
em outros locais. Sua estratégia envolveu intervenção precoce e pronação
acordada com cânula nasal de alto fluxo ou ventilação mecânica não invasiva,
para evitar o colapso alveolar[47].
Caputo
e col., em uma série de casos que descrevem 50 pacientes com COVID-19 que
se apresentaram ao departamento de emergência do Lincoln Hospital (New York,
USA) com saturação de oxigênio < 90%, sendo tratados inicialmente com cânula
nasal ou máscara facial de oxigênio não reinalante. A saturação média de
oxigênio apesar desses dispositivos tradicionais foi de 84%. Todos eles teriam
indicação de intubação precoce. Entretanto, os pacientes foram instruídos a
permanecer na posição prona acordados. Em cinco minutos, a saturação média de
oxigênio aumentou dez pontos, para 94%. Apesar dessas melhorias, 18 pacientes
(36%) necessitaram de intubação (13 nas primeiras 24 horas, 3 nas 24-48 horas e
2 nas 72 horas). A maioria dos pacientes parece ter sido tratado com uma
estratégia de rotação posicional contínua (por exemplo, 30 a 120 minutos em
decúbito ventral, seguida de decúbito lateral esquerdo, decúbito lateral
direito e posição supina). 64% dos pacientes melhoraram e evitaram a
intubação[48]. Essa
taxa de sucesso, se assemelha ao BiPAP que reduz a necessidade de intubação na
exacerbação da DPOC na mesma quantidade (65%). No caso do BiPAP na DPOC, essa
redução de 65% na taxa de intubação se correlaciona com uma redução na
mortalidade de 46%. Portanto, uma redução nas taxas de intubação em 64% é um
enorme benefício que provavelmente está relacionado à melhora da mortalidade.
Certamente, este estudo não é um trial, mas parece representar uma descrição
realista da aplicação de uma intervenção durante uma pandemia. Como os
pacientes inicialmente atenderam aos critérios de “intubação precoce” para
intubação, os pacientes serviram efetivamente como seus próprios controles.
Slessarev
M. e col., publicaram um relato de caso de um paciente com pneumonia grave
por COVID-19, que foi tratado com uma combinação de cânula nasal de alto fluxo
(inicialmente a 60 litros/min e 90% de 02) e pronação por 16 a 18 horas por dia
(incluindo 8 a 10 horas à noite). Pronação correspondeu a melhorias cíclicas na
oxigenação. Durante o dia, ele era capaz de comer, se comunicar com sua família
e participar de fisioterapia autodirigida. No 4º dia teve alta para enfermaria
sem necessidade de intubação. Um relatório recente da Itália feito por
Gattinoni e colaboradores, descreve 2 fenótipos de pneumonia por COVID-19. Na
fase inicial, muitos pacientes apresentam hipoxemia grave na ausência de dispnéia
e com complacência pulmonar preservada, baixo peso pulmonar, baixa relação ventilação/perfusão
(V/Q) e recrutabilidade pulmonar (definida como o fenótipo L). Com
tempo, alguns desses pacientes evoluem para uma SARA mais clássica, com baixa
complacência pulmonar, alto peso pulmonar, alto grau de shunt e pulmão alta recrutabilidade
pulmonar (definida como o fenótipo H). Muito provavelmente o paciente do
caso reportado tenha sido inicialmente um fenótipo L que evolui após 2 dias
para um fenótipo H. A razão proposta para hipoxemia no fenótipo inicial L é a
desregulação da perfusão pulmonar e a ausência do fenômeno de vasoconstrição
hipóxica (não havendo grandes áreas mal ventiladas, não se deflagra o mecanismo
de vasoconstrição com redistribuição de fluxo para áreas mais bem ventiladas)
com consequente vasoplegia e hipoxia. A infecção viral leva inicialmente a um
edema intersticial subpleural local modesto (lesões em vidro fosco)
particularmente localizado nas interfaces entre estruturas pulmonares com
diferentes propriedades elásticas, onde o estresse e tensão são concentrados. A
vasoplegia é responsável por hipoxemia grave. A resposta normal a hipoxemia é
aumentar a ventilação minuto, principalmente aumentando o volume corrente (até
15-20ml/kg), que está associado a uma pressão inspiratória intratorácica mais
negativa. Outros fatores além da hipoxemia, estimulam acentuadamente, nesses
pacientes, o impulso respiratório. Este aumento na ventilação minuto leva a uma
diminuição na PaCO2. Os pacientes do tipo L podem permanecer inalterados por um
período e, em seguida, melhorar ou piorar. A possível característica que
determina a evolução da doença - além da gravidade da própria doença, é a profundidade
da pressão intratorácica negativa associada ao aumento do volume corrente em respiração
espontânea. De fato, a combinação de pressão intratorácica inspiratória
negativa e aumento da permeabilidade pulmonar devido a inflamação, resulta em
edema intersticial pulmonar. Este fenômeno, inicialmente descrito por Barach em
1938 e Mascheroni em 1988, ambos em um ambiente experimental, foi recentemente
reconhecida como a principal causa de lesão pulmonar autoinfligida pelo
paciente (P-SILI). Com o tempo, o aumento do edema aumenta o peso pulmonar, a
pressão sobreposta e as atelectasias dependentes. Quando o edema pulmonar
atinge uma certa magnitude, o volume de gás no pulmão diminui e os volumes
gerados para uma dada pressão inspiratória diminuem. Nesta fase, a dispnéia se agrava,
que por sua vez leva ao agravamento do P-SILI. A transição do tipo L para o
tipo H pode ser devido à evolução da pneumonia COVID-19, por um lado, e a lesão
atribuível à alta tensão ventilatória por outro. As regiões pulmonares dorsais
têm mais tecido pulmonar, vasculatura mais densa, resultando em menor resistência
pulmonar e baixa vasoconstrição pulmonar hipóxica devido à maior expressão
endotelial óxido nítrico. A posição prona resulta em maior distribuição do
tecido pulmonar entre as regiões dorsal e ventral levando a uma arquitetura
alveolar mais uniforme. Além disso, também leva a uma distribuição mais
uniforme da perfusão pulmonar, reduzindo a heterogeneidade regional da relação
V/Q, melhorando a oxigenação. É possível que a oxigenação melhorada evite o
agravamento da dispnéia, enquanto a redistribuição do tecido pulmonar alterando
a relação tensão-esforço pulmonar e as forças intratorácicas, retardam a
formação de edema pulmonar e a progressão da doença do fenótipo L para H[49] [50].
Alguns
ensaios clínicos (RCT) em andamento poderão nos trazer melhores evidências
quanto à efetividade e segurança desta estratégia:
1.
Prone Positioning in Spontaneously Breathing Nonintubated Covid-19 Patient: a
Pilot Study (ProCov). ELHARRAR Xavier, Centre Hospitalier Intercommunal
Aix-Pertuis/France (https://clinicaltrials.gov/ct2/show/NCT04344106).
-
Os participantes do grupo intervenção (pacientes adultos >18 anos com
COVID-19, não intubados em respiração espontânea) serão pronados por um tempo
ideal de 3 horas.
-
Desfecho primário:
·
Proporção de pacientes que respondem "à
posição prona" (Período mínimo de duração da manobra: 1 hora) – “paciente
respondedor”.
Ø
Melhora da PaO2 > 20% após 1 hora em posição
prona em pacientes
-
Desfechos secundários:
·
proporção de pacientes com "resposta
persistente" após posição prona (Período: 1 dia) – “paciente respondedor
persistente”.
Ø
Melhora da PaO2 > 20% 6 a 12 horas após
retorno à posição supina (ressupinação).
·
Evolução da PaO2 (Período: 1 dia)
Ø
PaO2 1 hora após o início da posição prona e 6 a
12 horas após o retorno à posição supina.
·
Duração da posição prona e evolução da PaO2 (Período:
2 dias)
Ø
Procurar uma associação entre o tempo de posição
prona e a resposta persistente ou não.
·
Evolução do SpO2 (Período: 1 hora)
Proporção de pacientes que melhoram a SpO2 dentro de 1 hora
após a posição prona.
·
Dispnéia [Período: 1 dia]
Ø
Evolução da dispnéia (escores) 1 hora após o
início da posição prona e 6 horas após o final da posição prona
·
Intolerância à posição prona (Período: 1 dia) – “paciente
intolerante”
Ø
Proporção de pacientes que toleram a posição <
1 hora
·
Tolerância à posição prona (Período: 1 dia) – “paciente
tolerante”
Ø
proporção de pacientes que conseguem manter a
posição prona por mais de 3 h.
Critérios
de Inclusão:
·
18 anos ou mais;
·
COVID 19 positivo por RT-PCR ou diagnóstico de
sintomas clínicos e lesão tomográfica de tórax altamente suspeita durante o período
de pandemia;
·
TC de tórax sem contraste dentro de 72 horas antes
da inclusão;
·
Lesões tomográficas bilaterais, incluindo
condensações posteriores e / ou predominância posterior de lesões;
·
Hospitalizado em uma unidade COVID ou unidade de
terapia intensiva;
·
Respiração espontânea e oxigenoterapia com
cânula nasal, máscara ou oxigenoterapia de alto fluxo;
·
Necessidade de oxigenoterapia ≥ 1l para Sat ≥
90%;
·
Paciente que se beneficia da previdência social
francesa, sob qualquer regime
Critério
de exclusão:
·
Desconforto respiratório agudo (taquipneia >
25ipm ou uso de músculos respiratórios acessórios);
·
Alteração do nível de consciência;
·
Hemoptise ativa ou recente (<1 mês);
·
Tromboembolismo venoso recente (<1 mês);
·
Derrame pericárdico;
·
Derrame pleural severo, clínico ou por imagem;
·
Dor crônica nas costas ou cervical / história de
cirurgia da coluna vertebral / metástases ósseas;
·
Feridas, trauma facial, cirurgia traqueal,
esternal ou facial <15 dias;
·
Cirurgia abdominal recente (<1 mês);
·
Hipertensão Intracraniana> 30mmHg;
·
Paciente privado de liberdade, sob tutela ou
curadoria;
·
Mulher grávida ou amamentando.
2.
Impact of Prone Position in Patients Under Spontaneous Breathing on Intubation
or Non-invasive Ventilation or Death Incidence During COVID-19 Acute
Respiratory Distress (PROVID-19). Centre Hospitalier Régional d'Orléans/France.
Este é um estudo controlado randomizado, multicêntrico que deverá inlcuir 400
pacientes com diagnóstico de COVID-19 e submetidos à oxigenoterapia
convencional (grupo controle) ou a posição prona (gripo intervenção) aleatoriamente
designados, em uma proporção de 1: 1. O grupo controle manterá o paciente em
posição convencional: semissentado na cama ou sentado em uma cadeira. A posição
prona não será permitida durante o dia (será permitida à noite se for a posição
natural de dormir). O grupo de intervenção submeterá o paciente a sessões de 30
minutos a 1 hora de posição prona, seguidas de 2 horas de posição convencional
(semissentado na cama ou sentando na cadeira). O objetivo é 5 sessões de
posição prona durante o dia entre as 7h e as 22h. O máximo de posição prona à
noite. Os pacientes devem poder se posicionar sozinhos ou com assistência
mínima. O paciente estará livre para escolher sua posição prona preferida (https://clinicaltrials.gov/ct2/show/NCT04363463?term=Prone+Positioning+in+Spontaneously+Breathing&draw=2&rank=2).
-
Desfecho primário:
·
Porcentagem de idade dos pacientes que serão
submetidos a intubação endotraqueal ou ventilação não invasiva em dois níveis
de pressão e/ou morrerão, em cada um dos 2 grupos de randomização. [Período: 28
dias]
Ø
Mostrar que a posição prona em pacientes com
ventilação espontânea pode reduzir o risco de adquirir o seguinte evento (endpoint
composto):
§
Intubação endotraqueal
§
Ou ventilação não invasiva (VNI) com dois níveis
de pressão
§
E / ou morte
-
Desfechos secundários:
·
Duração em dias para a mudança de 2 pontos na
escala ordinal da OMS [Período: Dia 28]
Ø
Mostrar que o uso da posição prona melhora a
pontuação da escala ordinal da OMS em 2 pontos mais rapidamente (após a
randomização)
·
Taxa (%) de intubação e ventilação invasiva nos
2 grupos de randomização. [Período: dia 28]
Ø
Mostrar que a posição prona com ventilação
espontânea reduz a necessidade de intubação endotraqueal e ventilação mecânica
invasiva
·
Taxa (%) de ventilação não invasiva em dois
níveis de pressão nos 2 grupos de randomização [Período: Dia 28]
Ø
Mostrar que a posição prona com ventilação
espontânea reduz o uso de ventilação não invasiva em dois níveis de pressão
·
Duração da oxigenoterapia nos 2 grupos de
randomização. [Período: dia 28]
Ø
Mostrar que a posição prona na ventilação
espontânea reduz o tempo sob oxigenoterapia.
·
Duração da internação nos 2 grupos de
randomização. [Período: dia 28]
Ø
Mostrar que a posição prona reduz o tempo de
hospitalização.
·
Mortalidade hospitalar e mortalidade em D28 nos
2 grupos de randomização [Período: Dia 28]
Ø
Comparar a mortalidade hospitalar dos 2 grupos
·
Taxa (%) de necessidade de transferência para
unidade de terapia intensiva [Período: dia 28]
Ø
Comparar a incidência da necessidade de
transferência de ressuscitação entre os dois grupos.
·
Taxa (%) de uso de ventilação não invasiva em
dois níveis de pressão, intubação durante toda a estadia, quando a estadia for
superior a 28 dias. [Prazo: 1 ano]
Ø
Comparar o impacto do uso de ventilação não
invasiva e intubação em toda a internação hospitalar quando a internação for
superior a 28 dias entre os dois grupos.
Critério
de inclusão:
·
Pacientes de 18 a 85 anos
·
Com confirmação de COVID-19
·
Em tratamento com oxigenoterapia (cânula nasal,
máscara de média ou alta concentração ou cânula nasal de alto fluxo)
·
Capaz de mudar para a posição prona sozinho ou
com assistência mínima
·
Termo de consentimento Livre e Esclarecido
(TCLE)
·
Hospitalizado na unidade COVID por menos de 72
horas
Critério
de exclusão:
·
Mulheres grávidas (teste positivo de gravidez
durante a triagem) ou amamentando
·
Paciente em uso de oxigenoterapia prolongada ou
pressão positiva contínua nas vias aéreas (CPAP) ou ventilação não invasiva
(VNI) em casa
·
Doença Pulmonar Obstrutiva Crônica (DPOC),
estágio 3 ou 4
·
Paciente com doença pulmonar intersticial difusa
crônica conhecida
·
Paciente com patologia neuromuscular
·
Contraindicação a posição prona (trauma torácico
recente, pneumotórax, fratura ortopédica impedindo mobilização, etc)
·
Trombose venosa profunda dos membros inferiores
com anticoagulação eficaz por menos de 48 horas
·
Instabilidade hemodinâmica (PAM <65 mm Hg)
persistindo por mais de 1 hora
·
Frequência respiratória superior a 40 ciclos por
minuto
·
Uso excessivo dos músculos respiratórios
acessórios (a critério do clínico)
·
Indicação para VNI curativa (edema pulmonar
agudo ou insuficiência respiratória hipercápnica aguda)
·
Síndrome Oclusiva Intestinal
·
Paciente incapaz de proteger as vias aéreas
superiores
·
Incapacidade de entender o francês ou de seguir
instruções para a posição prona.
·
Pessoa sob tutela
·
Maiores Protegidos
·
Não afiliado à segurança social francesa
·
Decisão de não renunciar à terapia de manutenção
da vida
·
O paciente recebeu alta de uma unidade de
terapia intensiva e foi tratado por ventilação mecânica invasiva ou não
invasiva a 2 níveis de pressão durante a ressuscitação.
De acordo com os resultados do estudo de Ding L. e col. já citando anteriormente,
posição prona poderia ser combinada com uma variedade de técnicas adicionais:
·
Prona + ar ambiente
·
Prona + sistema de oxigenoterapia de baixo fluxo
·
Prona + CANF
·
Prona + VNI (BiPAP/CPAP através de uma máscara
facial)
·
Prona + VNI (BiPAP/CPAP através de uma interface
de capacete ou helmet).
Ainda,
visando reduzir a aerossolização dispositivos podem ser adaptados como aqueles
recentemente divulgados (capsulas isolantes com sistemas de sucção/aspiração e
tratamento de ar com filtro HEPA, máscaras full-face adaptadas com acoplamento
de filtros HEPA).
Muito
embora ainda sejam poucas as evidências do uso da posição prona em pacientes em
ventilação espontânea, a atual conjuntura de pandemia tem motivado que diversas
instituições tenham adotado protocolos em diversas instituições nacionais e
internacionais[51]
[52].
4.2.1. TÉCNICA PROTOCOLIZADA
De
acordo com a literatura apresentada e experiencias existentes adota-se o
seguinte PROTOCOLO PARA PACIENTES COVID-19:
1.
Paciente com suporte de oxigênio para atingir
SaO2 = 92 - 96% (88-92% se houver risco de insuficiência respiratória
hipercápnica) E suspeita/confirmação de COVID-19.
2.
Considere posição prona, se paciente tiver
capacidade de:
- Comunicar-se e cooperar com o
procedimento.
- Mudar de posição de forma independente
- Não tiver risco de via aérea difícil
3.
Avalie Contraindicações:
3.1
Contraindicações absolutas
-
Desconforto respiratório (FR ≥ 35, PaCO2 ≥ 65mmHg, uso muscular acessório)
-
Necessidade imediata de intubação
-
Instabilidade hemodinâmica (PAS <90mmHg) ou arritmia
-
Agitação ou estado mental alterado
-
Coluna instável / lesão torácica / cirurgia abdominal recente
3.2
Contraindicações relativas:
-
Lesão facial
-
Problemas neurológicos (por exemplo, convulsões frequentes)
-
Obesidade mórbida
-
Gravidez (2/3 trimestres)
-
Feridas por pressão / úlceras
-
Recusa terapêutica
4.
Siga a técnica padronizada:
-
Explicar ao paciente o procedimento, riscos e benefícios, obtendo o seu
consentimento (registrar em prontuário)
-
Se possível acoplar sistema de redução de aerossolização (capsulas isolantes
com sistemas de sucção/aspiração e tratamento de ar com filtro HEPA, máscaras
full-face adaptadas com acoplamento de filtros HEPA)
-
Garantir oxigenoterapia e suporte respiratório básico seguros (ver métodos
combinados descritos com preferência para VNI)
-
Acoplar kit de almofadas para proteger os pontos de pressão (face, tórax,
bacia, joelhos)
-
Orientar e instruir o paciente a adotar a posição do nadador ou com os braços estendidos
por cima da cabeça, ou na posição em que melhor o paciente se adapte, mantendo-se
pronado.
-
A posição do trendelenberg reverso pode ajudar no conforto.
-
Monitorar saturação arterial de oxigênio. Se houver queda, garanta que o O2
esteja conectado e funcionando
-
A sedação não deve ser administrada para facilitar a pronação
5.
Monitore as saturações de oxigênio por 15
minutos e observe se atinge a meta prevista: SaO2 = 92-96% (88-92% se
houver risco de insuficiência respiratória hipercápnica) e nenhum desconforto
evidente.
5.1 Meta
atingida:
Continue
na posição prona:
-
Mude de posição a cada 0.5 - 2 horas, com o objetivo de obter um tempo de
pronação maior possível:
·
30 minutos a 2 horas totalmente deitado em prona
(cama plana)
·
30 minutos a 2 horas no lado direito (cama
plana)
·
30 minutos a 2 horas sentado (30-60 graus)
ajustando a cabeceira da cama
·
30 minutos a 2 horas deitado no lado esquerdo
(cama plana)
·
30 minutos a 2 horas totalmente deitado em prona
de novo
·
Repita o ciclo …….
-
Monitorar saturações de oxigênio após cada mudança de posição
-
Titule os requisitos de oxigênio conforme possível
-
Não há limite de dias para uso da estratégia de prona, enquanto ela atinja os
objetivos de melhora
5.2 Se meta não for atingida
ou piorar a saturação de oxigênio:
- Verifique se o oxigênio está
conectado ao paciente
- Aumentar a Fi02
- Alterar a posição do paciente
- Considere retornar à posição
supina
5.3 Considerar intubação e transferência a UTI
se:
- Nenhuma melhoria for obtida com
a pronação (fracasso terapêutico)
- Paciente incapaz de tolerar a
posição prona
- Insuficiência respiratória clínica
(FR ≥ 35, dispneico, usando músculos acessórios)
4.2.3 VIDEOS ILUSTRATIVOS
[1] https://www.studocu.com/pt-br/document/universidade-de-ribeirao-preto/histologia/resumos/fisiologia-respiratoria/5394689/view
[2] Guyton e Hall. Tratado de Fisiologia Médica. Tradução
da 13ª edição. 2017.
[3] https://www.uptodate.com/contents/prone-ventilation-for-adult-patients-with-acute-respiratory-distress-syndrome?search=prone%20positioning%20adult&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1
[4] Ferran Roche-Campo, et.al. Prone positioning in acute
respiratory distress syndrome (ARDS): When and how?. tome 40 > n812 >
décembre 2011. doi: 10.1016/j.lpm.2011.03.019
[5] Lee JM. et.al.,
The efficacy and safety of prone positional ventilation in acute respiratory
distress syndrome: updated study-level meta-analysis of 11 randomized
controlled trials. Crit Care Med. 2014 May;42(5):1252-62. doi:
10.1097/CCM.0000000000000122.
[6] Sud S. et.al., Effect of prone positioning during
mechanical ventilation on mortality among patients with acute respiratory
distress syndrome: a systematic review and meta-analysis. CMAJ. 2014 Jul
8;186(10):E381-90. doi: 10.1503/cmaj.140081. Epub 2014 May 26.
[7] Eric L. Scholten, MD. et.al., Treatment of ARDS With
Prone Positioning. CHEST 2017; 151(1):215-224
[8] Aguirre-Bermeo H. et.al, Lung volumes and lung volume
recruitment in ARDS: a comparison between supine and prone position. Ann
Intensive Care. 2018 Feb 14;8(1):25. doi: 10.1186/s13613-018-0371-0.
[9] Bos LD. et.al., ARDS: challenges in patient care and
frontiers in research. Eur Respir Rev. 2018 Jan 24;27(147). pii: 170107. doi:
10.1183/16000617.0107-2017. Print 2018 Mar 31.
[10] Joseph C. Keenan. et.al., PEEP titration: the effect
of prone position and abdominal pressure in an ARDS model. Intensive Care Med
Exp. 2018 Jan 30;6(1):3. doi: 10.1186/s40635-018-0170-9.
[11] Fan E. et. al., Acute Respiratory Distress Syndrome:
Advances in Diagnosis and Treatment. JAMA. 2018 Feb 20;319(7):698-710. doi:
10.1001/jama.2017.21907.
[12] Michael D. Howell. et. al., Management of ARDS in
Adults. JAMA. 2018;319(7):711-712. doi:10.1001/jama.2018.0307.
[13] Luciano Gattinoni, MD. et.al., Prone Positioning in
Acute Respiratory Distress Syndrome. Semin Respir Crit Care Med 2019;40:94–100.
[14] Guérin
C. et.al., Prone positioning in severe acute respiratory distress syndrome.
Send to N Engl J Med. 2013 Jun 6;368(23):2159-68. doi: 10.1056/NEJMoa1214103.
Epub 2013 May 20.
[15] Taccone
P, Pesenti A, Latini R, et al. Prone positioning in patients with moderate and
severe acute respiratory distress syndrome: a randomized controlled trial. JAMA
2009;302:1977-84.
[16] Gattinoni L, Tognoni G, Pesenti A, et al. Effect of
prone positioning on the survival of patients with acute respiratory failure. N
Engl J Med 2001;345:568-73.
[17] Guerin C, Gaillard S, Lemasson S, et al. Effects of
systematic prone positioning in hypoxemic acute respiratory failure: a
randomized controlled trial. JAMA 2004;292:2379-87.
[18] Fernandez R, Trenchs X, Klamburg J, et al. Prone
positioning in acute respiratory distress syndrome: a multicenter randomized clinical
trial. Intensive Care Med 2008;34:1487-91.
[19] Chan MC, Hsu JY, Liu HH, et al. Effects of prone
position on inflammatory markers in patients with ARDS due to communityacquired
pneumonia. J Formos Med Assoc 2007;106:708-16.
[20] Mancebo J, Fernandez R, Blanch L, et al. A multicenter
trial of prolonged prone ventilation in severe acute respiratory distress syndrome.
Am J Respir Crit Care Med 2006;173:1233-9.
[21] Curley MA, Hibberd PL, Fineman LD, et al. Effect of prone
positioning on clinical outcomes in children with acute lung injury: a
randomized controlled trial. JAMA 2005;294:229-37.
[22] Voggenreiter G, Aufmkolk M, Stiletto RJ, et al. Prone
positioning improves oxygenation in post-traumatic lung injury — a prospective randomized
trial. J Trauma 2005;59:333-41, discussion 341-3.
[23] Beuret P, Carton MJ, Nourdine K, et al. Prone position
as prevention of lung injury in comatose patients: a prospective, randomized, controlled
study. Intensive Care Med 2002;28:564-9.
[24] Watanabe I, Fujihara H, Sato K, et al. Beneficial
effect of a prone position for patients with hypoxemia after transthoracic esophagectomy.
Crit Care Med 2002;30:1799-802.
[25] Sachin Sud MD MSc. Et. al., Effect of prone
positioning during mechanical ventilation on mortality among patients with
acute respiratory distress syndrome: a systematic review and meta-analysis. Canadian
Medical Association - CMAJ, July 8, 2014, 186(10)
[26] Jeremy R. Beitler, et.al., Prone positioning reduces
mortality from acute respiratory distress syndrome in the low tidal
volume era: a meta-analysis
[27] Shu Ling Hu. et.al., The effect of prone positioning
on mortality in patients with acute respiratory distress syndrome:
a meta-analysis of randomized controlled trials
[28] So Young Park. et.al., The efficacy and safety of
prone positioning in adults patients with acute respiratory distress syndrome:
a meta-analysis of randomized controlled trials
[29] Prone position for acute respiratory failure in adults.
Cochrane Database Syst Rev. 2015 Nov; 2015(11): CD008095.
Published online 2015 Nov 13. doi: 10.1002/14651858.CD008095.pub2
[30] Diretrizes Brasileira de Ventilação Mecânica –
AMIB/SBPT (2013): https://edisciplinas.usp.br/pluginfile.php/237544/mod_resource/content/1/Consenso%20VM%202013.pdf
[31] Claude Guerin. Prone positioning acute respiratory
distress syndrome patients. Ann Transl Med 2017;5(14):289.
[32] Munshi L. et.al., Prone Position for Acute Respiratory
Distress Syndrome. A Systematic Review and Meta-Analysis. Ann Am Thorac Soc.
2017 Oct;14(Supplement_4):S280-S288. doi: 10.1513/AnnalsATS.201704-343OT.
[33] Cavalcanti AB. et.al., Effect of Lung Recruitment and
Titrated Positive End-Expiratory Pressure (PEEP) vs Low PEEP on Mortality in
Patients With Acute Respiratory Distress Syndrome: A Randomized Clinical Trial.
JAMA. 2017 Oct 10;318(14):1335-1345. doi: 10.1001/jama.2017.14171.
[34] Guérin C. et.al., A prospective international
observational prevalence study on prone positioning of ARDS patients: the APRONET
(ARDS Prone Position Network) study. Intensive Care Med. 2018 Jan;44(1):22-37.
doi: 10.1007/s00134-017-4996-5. Epub 2017 Dec 7.
[35] An Official American Thoracic Society/European Society
of Intensive Care Medicine/Society of Critical Care Medicine Clinical Practice
Guideline: Mechanical Ventilation in Adult Patients with Acute Respiratory
Distress Syndrome. Am J Respir Crit Care Med. 2017 May 1;195(9):1253-1263. doi:
10.1164/rccm.201703-0548ST.
[36] Gattinoni L. et.al., Prone Positioning in Acute
Respiratory Distress Syndrome. Semin Respir Crit Care Med. 2019
Feb;40(1):94-100. doi: 10.1055/s-0039-1685180. Epub 2019 May 6.
[37] Umbrello M. et.al., Pathophysiology and Management of
Acute Respiratory Distress Syndrome in Obese Patients. Semin Respir Crit Care
Med. 2019 Feb;40(1):40-56. doi: 10.1055/s-0039-1685179. Epub 2019 May 6.
[38] Ventilação com posição prona | Benefícios e cuidados.
Dr. Jorge Luis dos Santos Valiatti. Accessível em:
https://www.academiademedicina.com.br/genmedicina/ventilacao-com-posicao-prona-beneficios-e-cuidados/
[39] Posição Prona na Síndrome da Angústia Respiratória
Aguda (SARA): após muitas voltas, demonstra-se enfim, impacto importante na
sobrevida. Dr. Marcelo Alcantara, idealizador do X-lung. Acessível em:
https://xlung.net/articles/13
[40] https://www.uptodate.com/contents/prone-ventilation-for-adult-patients-with-acute-respiratory-distress-syndrome?search=prone%20positioning%20adult&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1
[41] Diretrizes Brasileira de Ventilação Mecânica –
AMIB/SBPT (2013): https://edisciplinas.usp.br/pluginfile.php/237544/mod_resource/content/1/Consenso%20VM%202013.pdf
[42] An Official American Thoracic Society/European Society
of Intensive Care Medicine/Society of Critical Care Medicine Clinical Practice
Guideline: Mechanical Ventilation in Adult Patients with Acute Respiratory
Distress Syndrome. Am J Respir Crit Care Med. 2017 May 1;195(9):1253-1263. doi:
10.1164/rccm.201703-0548ST.
[43] Intensive Care Society (ICS). Guidance For: Prone
Positioning in Adult Critical Care. https://www.ficm.ac.uk/sites/default/files/prone_position_in_adult_critical_care_2019.pdf
[44] Scaravilli V. et.al., Prone positioning improves
oxygenation in spontaneously breathing nonintubated patients with hypoxemic
acute respiratory failure: A retrospective study. J Crit Care. 2015
Dec;30(6):1390-4. doi: 10.1016/j.jcrc.2015.07.008. Epub 2015 Jul 16.
[45] PulmCrit Wee- Proning the non-intubated patient. September
21, 2016. https://emcrit.org/pulmcrit/proning-nonintubated/
[46] Ding, L., Wang, L., Ma, W. et al. Efficacy and safety
of early prone positioning combined with HFNC or NIV in moderate to severe
ARDS: a multi-center prospective cohort study. Crit Care 24, 28 (2020).
https://doi.org/10.1186/s13054-020-2738-5
[47] Sun Q, Qiu H, Huang M, Yang Y. Lower mortality of
COVID-19 by early recognition and intervention: experience from Jiangsu
Province. Ann Intensive Care. 2020;10(1):33. doi:10.1186/s13613-020-00650-2
[48] Caputo N, Strayer R, Levitan R. Early Self-Proning in
Awake, Non-intubated Patients in the Emergency Department: A Single ED’s
Experience during the COVID-19 Pandemic. Acad Emerg Med. April 2020.
doi:10.1111/acem.13994
[49] Slessarev M, Cheng J, Ondrejicka M, Arntfield R,
Critical Care Western Research Group. Patient self-proning with high-flow nasal
cannula improves oxygenation in COVID-19 pneumonia. Can J Anaesth. April 2020.
doi:10.1007/s12630-020-01661-0
[50] Gattinoni L, Chiumello D, Caironi P, et al. COVID-19
pneumonia: different respiratory treatment for different phenotypes? Intensive Care
Med 2020; DOI: https://doi.org/10.1007/s00134-020-06033- 2.
[51] Peter Bamford, Andrew Bentley, Jane Dean, David
Whitmore and Noamaan Wilson-Baig. ICS Guidance for Prone Positioning of the
Conscious COVID Patient 2020. https://emcrit.org/wp-content/uploads/2020/04/2020-04-12-Guidance-for-conscious-proning.pdf
[52] Massachusetts General Hospital Prone Positioning for
Non-Intubated Patients Guideline. https://www.massgeneral.org/assets/MGH/pdf/news/coronavirus/prone-positioning-protocol-for-non-intubated-patients.pdf