FLUIDORESPONSIVIDADE PELA VPP OU
Dr. Alejandro Enrique Barba Rodas. Médico Responsável Técnico e Coordenador da Unidade Coronariana da Santa Casa de São Jose dos Campos. Coordenador da Residência em Medicina Intensiva – COREME e membro do Grupo Técnico de Enfrentamento à COVID -19 da Santa Casa de São Jose dos Campos.
I.
CONCEITOS DE VOLEMIA E FLUIDORESPONSVIVIDADE.
Uma prática muito frequente do médico quando é informado que um paciente está fazendo um episódio de hipotensão arterial é pedir para “correr um sorinho de 500ml em 30 minutos” ou até de maior volume (“sorão”).
Certamente, a intenção do profissional, diante da suspeita de estar se iniciando um quadro de choque circulatório (independente da sua etiologia) é aumentar a volemia e o retorno venoso (RV) no ventrículo esquerdo (VE) e, com isso, aumentar o volume sistólico (VS), o débito cardíaco (DC = VS x FC) e finalmente a pressão arterial (PA = DC x RVS). Ou seja, a estratégia para aumentar a PA está baseada na meta de aumentar o DC através da denominada reposição volêmica[1].
Entretanto, sabe-se que apenas 50% dos pacientes graves aumentam seu DC após a infusão de um volume de fluidos[2].
Há uma certa confusão no entendimento dos conceitos de “volemia”, “hipovolemia” e “hipervolemia”. Também entre os termos, “reposição volêmica”, “expansão volêmica” “ressuscitação volêmica” “prova de volume” e “desafio de fluidos”. Ainda outros termos como “volume circulante efetivo (VCE)” e “volume estressado e não estressado” contribuem ainda mais para essa confusão.
A rigor, o termo volemia significa volume sanguíneo corporal total, e refere-se à quantidade total de sangue que circula nas artérias, veias, capilares, vênulas e nas câmaras do coração (volume intravascular + volume cardíaco intracavitário). Assim, poderíamos dizer de forma genérica, que corresponde ao volume sanguíneo circulante (VSC). A volemia seria o conteúdo e o sistema composto pelos vasos e pelo coração, o continente. Esse volume de sangue representa a soma do seu componente liquido, sólido e gasoso (gases dissolvidos). O componente liquido, é constituído pelo plasma que é responsável por cerca de 60% do volume total de sangue. O componente sólido, inclui principalmente glóbulos vermelhos (eritrócitos), glóbulos brancos (leucócitos) e plaquetas e representa cerca de 40%. A quantidade de sangue que circula dentro de um indivíduo depende de seu tamanho e peso, mas o adulto humano médio tem aproximadamente 5 litros de sangue circulando. As mulheres tendem a ter um volume de sangue mais baixo do que os homens. No entanto, o volume sanguíneo da mulher aumenta cerca de 50% durante a gravidez.
Existem duas equações para estimar o volume de sangue de acordo com o sexo, altura (A) e peso (P) do paciente. A Equação de Nadler, foi construída com base no trabalho do Dr. Allen em 1962, enquanto a Equação de Lemmens-Bernstein-Brodsky, é mais precisa para faixas mais altas de peso corporal e índices de massa corporal em pacientes sem doenças críticas[3].
Equação de Nadler[4]:
- Homens: Volume de sangue = (0,3669 × A³) + (0,03219 × P) + 0,6041
- Mulheres: Volume de sangue = (0,3561 × A³) + (0,03308 × P) + 0,1833
Equação Lemmens-Bernstein-Brodsky[5]:
- Volume de sangue = 70/[√(IMC/ 22)]
Cerca
de 84% do volume sanguíneo corporal total estão na circulação sistêmica e 16%,
no coração e nos pulmões. Dos 84% na circulação sistêmica, aproximadamente 64%
estão nas veias, 13% nas artérias e 7% nas arteríolas e capilares sistêmicos. O
coração contém 7% do sangue, e os vasos pulmonares, 9% (Fig. 1). O mais
surpreendente é o baixo volume sanguíneo nos capilares. É neles, entretanto,
que ocorre a função mais importante da circulação: a difusão de substâncias do
sangue para os tecidos e vice-versa[6].
Fig. 1. Distribuição da volemia no ser humano
Hipovolemia, deve ser entendida como uma diminuição no volume
sanguíneo circulante (volume intravascular + volume cardíaco intracavitário). Pode
resultar da perda real de volume sanguíneo circulante, seja de sangue total (após
hemorragia), de plasma ou apenas água (perdas para terceiro espaço,
desidratação) denominando-se neste caso de hipovolemia absoluta, já que
há perda real de conteúdo. Diferentemente, pode haver um aumento do continente,
ou seja, da capacitância dos vasos sanguíneos secundária a vasoplegia ou
vasodilatação, levando a uma desproporção entre continente e conteúdo,
sem perda real de volemia (conteúdo) denominando-se por esta razão de hipovolemia
relativa[7]. A
vasoplegia, embora não traduza hipovolemia real, provoca queda de pressão principalmente
arteriolar (principais vasos determinantes da resistência vascular sistémica) e,
por conseguinte de perfusão tissular. Ainda, quando há redução na pré-carga e
débito cardíaco, alguns usam o termo hipovolemia central, que pode ser
devido a hipovolemia absoluta e/ou hipovolemia relativa, bem como ser
decorrente da diminuição do retorno venoso devido ao aumento da pressão
intratorácica em pacientes submetidos a ventilação com pressão positiva. Em
pacientes graves, a maioria dos efeitos circulatórios são consequências da
hipovolemia central, que leva a redução global na perfusão tecidual devido à
queda no débito cardíaco. Esse é o conceito que tem importância prática. Em
estudos clínicos com pacientes graves, a hipovolemia é sinônimo de hipovolemia
central, sendo pragmaticamente caracterizada quando há aumento no débito
cardíaco em resposta a expansão volêmica nos pacientes com choque e/ou sinais
de má perfusão[8].
Já o termo hipervolemia, deveria ser usado para casos em que o volume sanguíneo circulante aumenta, como ocorre na insuficiência renal, insuficiência cardíaca congestiva, insuficiência hepática, síndromes de hiperosmolaridade ou nos casos de sobrecarga de fluidos administrados. A hipervolemia não controlada resulta e aumento da pressão hidrostática com extravasamento e acúmulo de liquido no espaço intersticial e em várias cavidades corporais (edema, ascite, derrames, etc.). Importante destacar que muito embora edema (anasarca), ascite ou derrames possam ser manifestações de hipervolemia, elas poderão coexistir com hipovolemia nos casos em que a volemia estiver, pelo contrário, reduzida. Seria o caso, de um paciente portador de ICC e anasarca, sofrer uma desidratação aguda por diarreia ou sudorese profusa.
Desta maneira, o termo reposição volêmica deveria ser reservado apenas para o manejo dos casos de hipovolemia absoluta, em que há uma reposição de volemia perdida. A administração de fluidos nos casos de hipovolemia relativa não poderia ter por objetivo “repor” algo que na verdade não se perdeu. Neste caso a administração de fluido visa, na verdade, aumentar o retorno venoso (RV) e assim desafiar a capacidade contrátil do ventrículo esquerdo (VE) para aumentar o volume sistólico (VS), constituindo por isso um desafio de fluido ou uma prova de volume. Neste caso, na verdade, está se aumentando a volemia para equiparar a relação continente/conteúdo e assim melhorar a perfusão tissular. Este desafio de fluido dependerá, portanto, da capacidade contrátil do ventrículo esquerdo que em resposta a um maior enchimento diastólico (e, portanto, a maior estiramento de fibra muscular miocárdica) provocado pelo aumento de volume diastólico final (VDF), aumentará seu volume sistólico (VS) e com isso seu DC (curva de Frank – Starling). O sucesso do desafio de fluído dependerá diretamente da resposta do VE, classificando o paciente como respondedor (fluidoresponsivo) ou não respondedor (não fluidoreponsivo), se o DC aumentar > 10 a 15% do seu valor prévio, conforme definição amplamente aceita[9] [10] [11]. O volume e tipo de fluido para provocar esse desafio ou prova também tem sido objeto de definição e classicamente tem sido usado cristaloides como SF 0.9% ou Ringer Lactato (500ml em 20 – 30 minutos) ou coloides como gelatina (250ml em 15 a 20 minutos), amido (100 a 250ml em 15 a 20 minutos), albumina 5% (200ml em 15 a 20 minutos) e albumina 20% (50ml em 15 minutos). Ainda se considera como um desafio de fluido o aumento de volume de sangue que se produz no teste de elevação passiva das pernas (250 – 350ml).
Em 1955, o Dr. Arthur Guyton, o famoso fisiologista americano, publicou um artigo no qual descreveu os fatores que influenciam a fisiologia do retorno venoso[12]. Naquele artigo, ele destacou três variáveis que afetam de forma independente o retorno venoso: a pressão do átrio direito (PAD), a pressão sistêmica média (PSM) e a resistência vascular (RV).
A PSM, é um conceito que provavelmente não recebe a atenção que merece, mas que do ponto de vista fisiopatológico possui bastante relevância. Isso pode ser devido às dificuldades encontradas para sua definição ou para sua compreensão e aferição. Tem recebido também o nome de pressão média de enchimento sistêmico (PMES) ou pressão circulatória média de enchimento (PCME). A PSM é o ponto em que a pressão no átrio direito está em seu valor máximo), e nesse ponto o retorno venoso é zero (uma vez que não há gradiente de pressão ou força motriz). A PSM é a pressão que seria medida em todo o sistema cardiovascular se o coração parasse de bater e o fluxo circulatório cessar. Note-se na figura abaixo (Fig.2), 2 pontos em que o retorno venoso zera em razão das mudanças da pressão do átrio direito (PAD). Considerando na linha horizontal os valores da PAD (Right atrial pressure), sendo “0” o ponto em que se equipara à pressão atmosférica (“0” é um valor de referência e não o valor real que dependerá do nível do mar em que for aferida). Em condições fisiológicas, quando a PAD cai abaixo da pressão atmosférica durante a inspiração profunda, por exemplo, as veias que entram no tórax colabam zerando o retorno venoso (aproximadamente -8mmHg). Pelo contrário quando a PAD vai aumentando progressivamente, o retorno venoso vai se reduzindo até chegar um ponto em que o mesmo também zera (aproximadamente a +7mmHg). Esse ponto denomina-se PSM.
Fig.2. Curva de retorno venoso normal (https://www.brainkart.com/article/Venous-Return-Curves_19320/)
Dois fatores influenciam o valor da pressão sistêmica média: (1) volume de sangue e (2) distribuição de sangue entre o volume estressado (submetido a tensão) e o volume não estressado (livre de tensão). O volume não estressado (considerado como o volume contido nas veias) é o volume de sangue na vasculatura que praticamente não exerce pressão sobre as paredes (pressão transmural = 0). Volume estressado (considerado como o volume contido nas artérias) é o volume que gera pressão sobre as paredes dos vasos (pressão transmural >0). Na realidade, é necessário um certo volume de líquido para preencher o leito vascular até o ponto em que sua presença começa a exercer pressão nas paredes dos vasos arteriais. Isso representa o volume não estressado. Qualquer volume acima deste nível será o volume estressado, que exercerá um grau crescente de pressão sobre o volume não estressado contido no leito venoso. Quanto maior o volume estressado maior o retorno venoso. Assim, a volemia pressupõe que uma parte dela (a maioria) estará no compartimento venoso e outra parte (a minoria) no compartimento arterial. Quando o volume de sangue varia entre 0 a 4L, todo sangue ficaria contido no compartimento venoso e a PSM será zero. Quando o volume de sangue total é 5L, 4L formarão o volume não estressado e 1L o volume estressado gerando uma pressão que produzirá um gradiente circulatório. Neste caso a PSM será de 7 mmHg. Assim, aumentos no volume estressado elevarão a PSM. Se o volume de sangue aumentar, o volume não estressado não mudará (caso esteja completamente cheio), enquanto o volume estressado aumentará. Aumentos de volume estressado deviam a PSM para direita e queda do volume estressado para esquerda. A redistribuição de sangue entre os compartimentos de volume não estressado e volume estressado também produzem mudanças na PSM. Por exemplo, se a complacência das veias diminui (venoconstrição por uso de vasopressor), desviará parte do seu volume para o volume estressado. Pelo contrário, se a complacência venosa aumentar (venoplegia com venodilatação) sequestrará parte do volume estressado, embora em ambos casos, a volemia permaneça inalterada. Em resumo, o aumento do volume sanguíneo e diminuição da complacência das veias aumentam a PSM e causa deslocamento do seu valor para a direita na curva de retorno venoso. Diminuição do volume de sangue e aumento da complacência das veias leva a diminuição da PSM e deslocamento para esquerda[13] [14]. (Fig. 3, 4, 5 e 6).
Fig. 3. Volume
estressado e não estressado
Fig. 4. (A) Volume estressado
responsável pela PSM (B) ilustrando como um desafio de fluido aumenta o retorno
venoso e (C) ilustrando como os vasopressores aumentam o retorno venoso.
Fig.5 Aumentos do
retorno venoso de acordo com mudanças do volume estressado e não estressado (https://anaesthesianews.wordpress.com/2018/05/08/contemporary-concepts-in-spinal-anaesthesia-pre
load-theory-vs-after-load-theory/)
Fig. 6. Relação
entre volume estressado, não estressado, volemia e PSM.
Na hipovolemia compensada, o volume circulatório perdido é compensado por uma redução equivalente no volume de sangue “não estressado”, mantendo-se assim o volume “estressado” e o débito cardíaco. Se mais volume é perdido, esses mecanismos compensatórios se tornam insuficientes, resultando na hipovolemia descompensada, com redução do retorno venoso e débito cardíaco. Em casos de vasodilatação, como na sepse, o volume de sangue “não estressado” aumenta e leva a redução do volume “estressado”, situação que caracteriza a hipovolemia relativa[15].
Importante
não confundir PSM com pressão de perfusão média (PPM) que expressa a
diferença entre a PAM e a PAD (ou PVC). Assim a PPM= PAM – PAD (ou PVC). Estudos
tem mostrado que muito embora PAM seja mantida dentro da meta preconizada (≥
65mmHg) quedas na PPM estão associadas a lesão renal aguda. Um estudo revelou
que pacientes com LRA estágio I com PPM ≤ 59 mmHg tiveram um risco significativamente
maior de progredir para estágio III de LRA. Essa associação foi mais forte em
pacientes com cardiopatia isquêmica, insuficiência cardíaca congestiva ou sem
hipertensão pré-existente e em pacientes com PAM <65 mmHg por > 1 h. Como
componentes individuais, um aumento da PVC foi independentemente associado à
progressão para o estágio III de LRA, mas a PAM isolada não foi um fator de
risco independente para a progressão de LRA. Assim PPM <60 mmHg foi
independentemente associada à progressão da LRA[16].
O volume circulante efetivo (VCE), refere-se à parte da volemia que está efetivamente perfundindo os tecidos. O volume circulante efetivo não é uma entidade quantitativamente mensurável, mas refere-se à taxa de perfusão da circulação capilar. O volume circulante efetivo é mantido pela variação da resistência vascular, do débito cardíaco, bem como da excreção renal de sódio e água. Diminuições no volume circulante efetivo resultam em diminuição do retorno venoso, diminuição do débito cardíaco e diminuição da pressão arterial. A diminuição do volume e da pressão são reconhecidas por receptores de volume especial na circulação cardiopulmonar e nos rins, que desencadeiam aumento do tônus simpático, resultando em aumento da constrição arterial e venosa, bem como aumento da contratilidade cardíaca e frequência cardíaca. Essas respostas tendem a corrigir o déficit de volume, aumentando o débito cardíaco e a pressão arterial sistêmica. As alterações de volume e pressão associadas a diminuições no volume circulante efetivo também resultam na ativação do sistema renina-angiotensina (SRRA) com subsequente aumento da secreção de aldosterona pelo córtex adrenal. A aldosterona atua aumentando a reabsorção renal de sódio, que é um fator crítico para manter e, eventualmente, restaurar o volume circulante efetivo. Fatores adicionais que influenciam a reabsorção de sódio em resposta a mudanças no volume de fluido incluem alterações na taxa de filtração glomerular, hemodinâmica renal, fator natriurético atrial e concentração plasmática de sódio[17].
Assim, pelas razões expostas, status volêmico de um paciente não se pode confundir com status de fluidoresponsividade. Um paciente pode estar normovolêmico, hipovolêmico ou hipervolêmico e poderá ser ou não fluidoresponsivo. Por outro lado, uma estratégia baseada no aumento do volume sistólico através do aumento da volemia decorrente da administração de fluidos, deveria ser chamada genericamente de ressuscitação volêmica ou de terapia de expansão volêmica, reservando o termo prova de volume ou desafio de fluidos para quando se pretenda avaliar fluidoresponsividade, e o termo reposição volêmica, para os casos de manejo de hipovolemia absoluta.
II.
CONCEITO DE FLUIDORESPONSIVIDADE E DO MÉTODO DINÂMICO
Como já dito anteriormente, paciente respondedor (fluidoresponsivo) ou não respondedor (não fluidoreponsivo) a uma prova de volume ou a um desafio de fluido, é definido quando seu DC aumentar > 10 a 15% do seu valor prévio.
Fisiologicamente, a responsividade a fluidos implica que ambos os ventrículos são responsivos a um aumento da pré-carga. Isso significa que eles operam na parte íngreme da curva traçada a partir da relação volume sistólico vs. pré-carga seguindo o mecanismo descrito por Otto Frank e Ernest Starling (Curva de Frank-Starling). De acordo com a teoria proposta e amplamente aceita, quando o coração está operando na parte íngreme da curva, um aumento na pré-carga (de A para B) resulta em um aumento no volume sistólico (paciente respondendor ou fluidoresponsivo). Quando o coração está operando na parte do platô da curva, o mesmo aumento na pré-carga cardíaca (de A para B) não resulta em um aumento significativo no volume sistólico (não respondedor ou não fluidoresponsivo) podendo gerar efeitos de sobrecarga volêmica (Fig. 7).
Fig. 7. Curva de
Frank - Starling
Uma revisão sistemática da literatura relatou que a responsividade a fluidos está presente em apenas 50% dos pacientes de UTI para os quais a decisão de administração de fluidos foi tomada pelo médico assistente[18]. No entanto, não se pode descartar a possibilidade de que o percentual seja maior se forem considerados apenas os pacientes em choque. No entanto, dado que a sobrecarga de fluidos pode causar danos aos pacientes da UTI[19], particularmente aos que não respondem a fluidos[20], é importante detectar a responsividade a fluidos antes de administrar qualquer fluido.
O método clássico para avaliar fluidoresponsividade tem sido a prova de volume ou o desafio de fluido em que se infunde um volume de fluido em um curto espaço de tempo (bolus), medindo antes e depois o DC para estimar sua variação. Entretanto, como já mencionado, mesmo o volume-teste poderia prejudicar aqueles que não respondedores, especialmente quando o teste é repetido com frequência.
Os
métodos dinâmicos, avaliam o status de fluidoresponsividade sem a
necessidade de qualquer infusão de fluidos. No final da década de 1990, a
quantificação da variação respiratória do volume sistólico surgiu como uma
aplicação prática dos princípios teóricos de interação coração-pulmão descritos
na década de 1980 por especialistas em fisiologia cardiovascular e respiratória.
O fundamento fisiológico é que a ventilação mecânica a pressão positiva em modo
controlado induz mudanças cíclicas no retorno venoso de ambos os ventrículos[21]
[22]
[23]
[24].
Na inspiração o retorno venoso (pré-carga) diminui no ventrículo direito (VD) devido
ao aumento inspiratório da pressão intratorácica. A inspiração geralmente
aumenta a pós-carga do VD como consequência do aumento inspiratório da pressão
transpulmonar[25],
especialmente quando a pressão alveolar provoca aumento da resistência vascular
pulmonar (vasos justa-alveolares). Como resultado, o volume sistólico do VD é mínimo
no final da insuflação. É geralmente assumido que a redução inspiratória no
retorno venoso é o mecanismo predominante, especialmente se o ventrículo
direito operar na parte íngreme da curva de Frank-Starling (responsividade da
pré-carga do VD). Ao mesmo tempo que o retorno venoso do VD diminui, aumenta o
retorno venoso do ventrículo esquerdo (VE) em razão do “shiffting” de sangue
dos capilares pulmonares e chegada dos volumes maiores ejetados pelo VD durante
a expiração previa. Durante a expiração ocorrem os fenômenos inversos, com
aumento do retorno venoso do VD e queda do retorno venoso no VE. As variações do
retorno venoso no VE em cada ciclo respiratório com aumento na fase
inspiratória, geram consequentemente aumento do volume sistólico (VS). Teremos,
portanto, maiores valores de volumes sistólico (VS) durante a inspiração e
menores durante a expiração. A partir desses princípios fisiológicos, foi
postulado que, durante a ventilação mecânica, grandes mudanças no volume
sistólico do VE devem ocorrer em casos de responsividade da pré-carga
biventricular, ao passo que nenhuma mudança no volume sistólico deve ocorrer se
pelo menos um ventrículo não responder à pré-carga[26].
Numerosos estudos têm demonstrado consistentemente que a magnitude da variação
respiratória do volume sistólico prediz a responsividade a fluidos com grande
precisão em pacientes ventilados mecanicamente[27]
[28]
[29].
III.
A VARIAÇÃO DA PRESSÃO DE PULSO (ΔPP) NOS DIAS DE HOJE
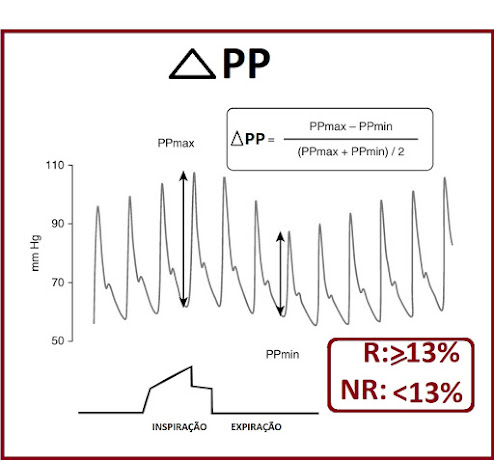
Define-se como pressão de pulso (PP), a diferença entre a pressão sistólica e pressão diastólica (PS – PD). Dentre todos os índices de responsividade a fluidos, a variação da pressão de pulso (VPP ou ΔPP) tem sido um dos mais estudados e mais utilizados na prática clínica.
A pressão de pulso aórtica é diretamente proporcional ao volume sistólico do VE e inversamente relacionada à complacência aórtica[30]. Frederick Michard e col. postularam que a VPP reflete as mudanças respiratórias no volume sistólico e, portanto, ajuda a avaliar a responsividade a fluidos[31].
No ano 2000, Frederick Michard e col., publicaram o clássico estudo validando o uso da VPP como marcador dinâmico de fluidoresponsividade (Fig. 8 e 9). O estudo foi feito em 40 pacientes com choque séptico, sob as seguintes condições:
- Sem arritmia
- Submetidos a ventilação mecânica controlada,
- Modo VCV,
- VC de 8 – 12ml/Kg,
- Relação I:E de1:2 ou 1:3 e
- PEEP de 7 ± 4 cmH2O.
Avaliaram a Variação da Pressão de Pulso e a Variação da Pressão Sistólica usando as seguintes formulas:
- VPP ou ΔPP (%) = PPmax – PPmin/[PPmax + PPmin/2] X 100
- VPS ou ΔPS (%) = PSmax – PSmin/[PSmax + PSmin/2] X 100.
Usaram como referência o DC aferido por termodiluição pulmonar (CAP) definindo como respondedor com base o índice cardíaco (IC) ≥ 15% e não respondedor < 15%. O desafio de fluidos foi feito com 500ml de hidroxietilstarch 6% (30 minutos de infusão). Encontraram que um ∆PP de13% permitiu a discriminação entre os respondedores (≥ 13%) e não respondedores (< 13%) com uma Sensibilidade de 94% e uma Especificidade de 96%. ∆PP foi um marcador de fluidoresponsividade mais acuras que o ∆PS[32]. Posteriormente outros estudos em diferentes ambientes clínicos confirmaram a utilidade da VPP como um preditor confiável de responsividade a fluidos em pacientes ventilados com um VC ≥ 8 ml/kg[33] [34], desde que não apresentem atividade respiratória espontânea e/ou arritmias cardíacas[35]. Numa meta-análise de 2009, incluindo 22 estudos e 807 pacientes, a VPP previu responsividade a fluidos com um cu-off de 12%.[36]
Fig. 8. VPP e Ciclo Respiratório
Fig. 9. VPP e Fluidoresponsividade
Entretanto, inexiste uma única estratégia de ventilação mecânica controlada para todos os pacientes. As modalidades ou modos ventilatórios e os parâmetros de volume corrente (VC), relação I:E e valores de PEEP variam a depender do tipo de paciente e de doença (SARA, DPOC, neurocrítico, cardiopata, etc.) ou do momento (recrutamento alveolar, desmame, etc.). Mais ainda, o advento da denominada estratégia protetora de ventilação mecânica para prevenção de lesão pulmonar induzida pela ventilação mecânica (VILI) estabeleceu parâmetros de VC limite (6ml/Kg) para pacientes com pulmão normal e de 4 a 6ml/Kg em pacientes com SARA grave. Ainda, as estratégias de recrutamento alveolar em regra pressupõem ventilação mecânica com baixos volumes correntes e altos níveis de PEEP o que foram tornando difícil o uso do cut-off de 13% do ΔPP nos moldes do estudo original de F. Michard e col. Havia que provisoriamente colocar o paciente nos parâmetros do estudo para aferir a VPP, o que significaria, mesmo que transitoriamente, períodos de alteração dos volumes e pressores ventilatórias com eventual impacto negativo nas metas atingidas ou risco de desrecrutamento quando o paciente já estava como valores de PEEP acima de os usados no estudo.
Em 2019, Jean-Louis Teboul, Xavier Monnet, Denis Chemla e Frédéric Michard, publicaram uma importante revisão abordando a evolução e mudanças ocorridas na aferição do ΔPP em pacientes sob ventilação mecânica controlada e cenários diferentes daqueles em que os pacientes foram estudados no estudo original[37].
|
Tabela 1. Condições em que a
variação da pressão de pulso é menos confiável |
|
|
Respiração espontânea |
False + |
|
Arritmia cardíaca |
False + |
|
VC baixo |
Falso - |
|
Baixa complacência pulmonar (Csr) |
Falso - |
|
Posicionamento em prona |
Falso - |
|
Aumento da pressão intra-abdominal |
False + |
|
Frequência respiratória muito alta (FC / FR <3,6) |
Falso - |
|
Disfunção ventricular direita |
False + |
Definição das abreviaturas: FC = frequência cardíaca; RR = frequência respiratória.
Pelo menos dois fatores limitam o uso da VPP na síndrome do desconforto respiratório agudo (SDRA): ventilação com VC baixo e complacência pulmonar baixa.
A ventilação com VC baixo (4 a 6 ml/kg) é recomendada em pacientes com SDRA. Nessas condições, as mudanças respiratórias na pressão intratorácica podem ser insuficientes para produzir alterações significativas no retorno venoso, gerando falsos (-). Consequentemente, havia uma previsão mais fraca quando o VC era inferior a 8 ml/kg usando um cut-off de 8%. No entanto, durante a VM com baixo VC ventilação, três questões importantes precisam ser destacadas. Primeiro, uma VPP alto (por exemplo > 12%) ainda sugere responsividade a fluidos. Em segundo lugar, uma VPP baixa não pode descartar a responsividade a fluidos. Terceiro, para superar a difícil interpretação da VPP baixa, estudos sugeriram medir a resposta com um aumento transitório (<1 min) no VC denominado a este método de teste de desafio de VC. Depois que o VC foi aumentado para 8 ml/kg, a VPP previu de forma mais confiável a resposta hemodinâmica à infusão de fluidos. Curiosamente, um aumento no valor absoluto ≥ 3,5% durante o desafio de VC previu responsividade a fluidos com excelente precisão. Outra forma sugerida para superar a limitação de VC baixo foi dividir a VPP pelas alterações respiratórias da pressão esofágica. A desvantagem de usar esse índice é a necessidade de uma sonda esofágica. Mais recentemente 2 revisões sistemáticas com metanálise de um grupo colombiano tem se aprofundado no estudo da acurácia da VPP em pacientes ventilados com VC baixo. Em janeiro de 2020, Alvarado S. Jorge e col., publicaram os resultados de uma metanálise na qual pesquisaram os bancos de dados PubMed e Embase em busca de artigos que avaliassem o desempenho da VPP como um preditor de responsividade a fluidos em pacientes críticos e adultos no perioperatório ventilados com volume corrente ⩽8 ml/kg sem esforço respiratório e arritmias, entre janeiro de 1990 e janeiro de 2019. Incluíram estudos de coorte e transversais. Foram encontrados 19 ensaios com um total de 777 pacientes e um total de 935 desafios de fluidos. A sensibilidade ajustada da VPP para prever a responsividade a fluidos durante a ventilação mecânica com VC ⩽8 ml/kg foi de 65% e a especificidade de 79%. A média do ponto de corte da VPP foi de 10,28%[38]. Em fevereiro de 2021, o mesmo grupo colombiano de Alvarado S. Jorge e col., publicaram uma segunda metanálise, desta vez avaliando vários marcadores de fluidoresponsividade em paciente ventilados com VC baixo (≤ 8ml/kg). A pesquisa foi realizada nas bases de dados Embase e MEDLINE, procurando estudos que avaliassem prospectivamente o desempenho da variação da pressão de pulso (VPP), variação do volume sistólico (VVS), o teste de oclusão expiratória final (TOEF), teste de elevação passiva das pernas (TEPP), o Índice de distensibilidade da VCI (IDVCI), desafio com minifluido (DMF) e o teste de desafio de volume corrente (TDVC), para prever a responsividade a fluidos em pacientes adultos ventilados mecanicamente com VC ≤ 8 ml/kg, sem esforço respiratório e arritmias. Um total de 33 estudos publicados entre 1999 e 2020 envolvendo 1.352 pacientes foram incluídos para análise. A maioria dos preditores de responsividade a fluidos foram confiáveis para avaliar a resposta do débito cardíaco à expansão de volume em pacientes adultos ventilados mecanicamente em volumes correntes ≤ 8 ml/kg. No entanto, observaram que as variáveis técnicas e clínicas podem influenciar claramente em seu desempenho. Para a VPP a média de corte acima do qual define paciente respondedor foi de 10%, para VVS 12%, TDVC 3%, IDVCI 16%, TOEF 5%, TEPP 13% e DMF 1%[39]. Ainda em 2021 Taccheri T. e col., publicaram um outro estudo em que mostram que a fluidoresponsividade também poderia ser avaliada através das mudanças do valor do cut-off de VPP após um desafio de VC (6ml/kg para 8ml/kg por 1 minuto) ou de um teste de elevação passiva das pernas (TEPP). No primeiro caso, o cut-off de VPP aumenta em > 20% (valores relativos) ou >1 ponto (em valor absoluto) em pacientes respondedores. No segundo caso, a VPP se reduz em ≤-20% (valores relativos) ou em ≤-2pontos (em valores absolutos) em pacientes respondedores[40].
A baixa complacência do pulmão e do sistema respiratório (Crs = VC/driving pressure), que são características da SDRA, também podem resultar em uma interpretação enganosa da VPP ao reduzir a transmissão da pressão das vias aéreas para as estruturas intratorácicas, resultando em falsos (-). Embora a complacência da parede torácica seja geralmente reduzida, o efeito resultante é uma diminuição na transmissão da pressão nas vias aéreas, conforme ilustrado pela correlação entre a Crs e a transmissão da pressão nas vias aéreas encontrada num estudo. Foi demonstrado que quando Crs era maior que 30 ml/cm H2O, a VPP previu com precisão a responsividade a fluidos, enquanto que quando Crs era menor ou igual a 30 ml/cm H2O, a previsão foi ruim essencialmente por causa de uma alta taxa de falsos negativos. Curiosamente, entre os que responderam a fluidos, houve um subconjunto de pacientes ventilados com um VC menor que 8 ml/kg, uma Crs maior que 30 ml/cm H2O e uma VPP alta, e outro subconjunto com um VC maior que 8 ml/kg, uma Crs menor ou igual a 30 ml/cm H2O e uma baixa VPP (5% em média), sugerindo que a diminuição da Crs pode desempenhar um papel mais importante do que o baixo VC no valor preditivo ruim da VPP.
Em caso de ventilação controlada com VC baixo, uma alta frequência respiratória usualmente é necessária para garantir volume minuto e evitar/tratar hipercapnia. Uma frequência respiratória alta provocará encurtamento da fase expiratória em cada ciclo ventilatório, reduzindo a possibilidade de gerar maiores volumes de enchimento do VD nesta fase. Tais volumes reduzidos quando cheguem ao VE na próxima fase inspiratória gerará falsos negativos na VPP. Um estudo clínico mostrou que a VPP não pode ser interpretada de forma confiável quando a relação frequência cardíaca/frequência respiratória é inferior a 3,6 (usualmente >4).
Além disso, o posicionamento prono é frequentemente usado em pacientes com SDRA grave. Um estudo clínico relatou um baixo valor preditivo da VPP durante o posicionamento prono em pacientes com SDRA, provavelmente devido ao baixo VC e baixa complacência pulmonar.
O nível de pressão expiratória final positiva (PEEP) não deve afetar o valor preditivo da VPP. De fato, a PEEP aumenta a pressão média das vias aéreas, mas não altera a variação cíclica da pressão das vias aéreas durante uma respiração mecânica, que é o principal determinante da VPP. A PEEP se mantendo constante, independente do seu valor exercerá seu efeito tanto na inspiração quanto na expiração. Algumas publicações que mostraram um bom valor preditivo da VPP durante a ventilação mecânica incluíram pacientes que receberam PEEP. Curiosamente, a VPP também pode ser usada para prever os efeitos hemodinâmicos da PEEP.
A atividade respiratória persistente durante a ventilação mecânica é comum, pois a recomendação atual é minimizar o uso de agentes sedativos e de bloqueio neuromuscular e permitir que o paciente use parcialmente seus músculos respiratórios, embora essa questão ainda seja motivo de debate. Nesses casos, a VPP não pode predizer a responsividade a fluidos, pois as alterações respiratórias da pressão intratorácica são irregulares, tanto na frequência quanto na amplitude.
2. VPP
e DISFUNÇÃO DO VD
Tem sido sugerido que a disfunção do VD poderia resultar em valores falso-positivos de VPP (ou seja, VPP alta apesar de paciente não ser fluidoresponsivo). Isso ocorreria devido ao efeito predominante da insuflação mecânica na pós-carga do VD por meio da compressão dos capilares justa-alveolares pela pressão transpulmonar, exacerbando o que já normalmente ocorre. Como um ventrículo direito dilatado e em falha é mais sensível à sua pós-carga do que à pré-carga, a diminuição do volume sistólico do VD durante a insuflação estaria mais relacionada à dependência da pós-carga do VD do que à pré-carga do VD. Os volumes que retornam ao VE durante a expiração serão ainda menores acentuando a PPmin e provocando um falso valor elevado da VPP. Dois estudos clínicos relataram altos valores de VPP (> 12%), apesar da ausência de resposta a fluidos no contexto de disfunção do VD. No entanto, nesses estudos, o VC foi maior que 8 ml/kg, e não se pode excluir uma atenuação do fenômeno de dependência da pós-carga do VD durante a ventilação com baixo VC. Ainda precisa avaliar o impacto da forma como se faz o diagnóstico de disfunção de VD para cada estudo.
3. VPP, ARRITMIAS e ICC
Poucos estudos abordaram a questão da responsividade a fluidos em pacientes com insuficiência cardíaca congestiva (ICC), provavelmente porque a administração de fluidos raramente é indicada nesses pacientes, em razão do receio de provocar uma sobrecarga volêmica aguda. Em alguns estudos, incluindo pacientes com disfunção ventricular esquerda e em ritmo sinusal, foi relatado que a VPP (ou VVS) prediz a responsividade a fluidos com uma precisão aceitável. No entanto, a presença de arritmias cardíacas é uma contraindicação óbvia para uso da VPP, pois a variação da pressão de pulso está relacionada principalmente à irregularidade da diástole cardíaca, independentemente do ciclo respiratório.
4. VPP e HIA
Dados experimentais sugerem que a VPP ainda pode predizer a responsividade a fluidos em casos de aumento da pressão intra-abdominal (PIA), mas que o valor do limiar pode ser maior do que no caso de pressão abdominal normal. No entanto, as condições experimentais (aumento agudo da pressão intra-abdominal, valores muito elevados de pressão intra-abdominal atingidos, VC alto e baixa complacência torácica) estavam distantes das encontradas em pacientes de UTI. Em uma série de pacientes ventilados com insuficiência hepática aguda, os autores concluíram que a VPP prediz a responsividade a fluidos, ao passo que as mudanças respiratórias na integral velocidade-tempo (VTI) não foram preditivas.
5.
VPP NA POPULAÇÃO GERAL DE PACIENTES
Um estudo observacional internacional publicado em 2015 investigou 2.213 pacientes para determinar se marcadores de responsividade a fluidos foram usados antes de realizar desafios de fluidos. A PVC foi o marcador mais utilizado (576 casos) em comparação com VPP ou VSS (176 casos) e o teste de elevação passiva da perna (248 casos). É provável que essas práticas evoluam, pois a versão mais recente das diretrizes da Surviving Sepsis Campaign sugere o uso de marcadores dinâmicos de responsividade a fluidos (incluindo VPP, quando aplicável) em vez de PVC quando maior administração de fluidos for necessária, após o bolus inicial.
A ventilação com VC baixo (6ml/kg) é comumente usada em pacientes gravemente enfermos sem SDRA, conforme mostrado por um estudo que envolveu 540 pacientes ventilados mecanicamente. A VPP, bem como os índices de responsividade a fluidos estimados pela ecocardiografia, não previram de forma confiável a responsividade ao fluido. No entanto, neste estudo, a responsividade a fluidos foi identificada pelo teste de elevação passiva das pernas e não pela administração de fluido. Como a elevação passiva da perna mostrou ser hemodinamicamente equivalente a um desafio de fluido de no mínimo 250 ml e no máximo, 350 ml de sangue (média de 312ml), provavelmente havia um número significativo de respondedores se tivesse sido usado um volume real de 500 ml e alguns não respondedores classificados como respondedores caso a auto infusão tenha significado um desafio com volume mínimo. Isso poderia explicar talvez algumas diferenças com estudos em que se uso uma administração real de fluidos.
As condições em que a confiabilidade da VPP é limitada são bastante comuns na UTI. Por exemplo, em um estudo prospectivo que incluiu pacientes de UTI que realmente receberam bolus de fluidos, a incidência de casos em que a VPP poderia ser usado sem limitação foi de 17%. Esta incidência pode variar em função da mistura dos casos e das configurações do ventilador. Outro estudo mostrou que, nos casos de choque, as condições de aplicabilidade da VPP estavam presentes em 39% dos pacientes com sepse e 53% dos pacientes com trauma.
6.
VPP E DESFECHOS
Em pacientes cirúrgicos, há fortes evidências de que as administrações insuficientes ou excessivas de fluidos estão associadas a um aumento da taxa de complicações pós-operatórias. É recomendado ajustar a administração de fluidos às necessidades individuais. Manter os pacientes próximos à parte íngreme da curva de Frank-Starling (ou seja, manter a VPP dentro da faixa de 10-15%) deve proteger contra as consequências da hipovolemia e da sobrecarga de fluidos. Uma meta-análise de 14 ensaios clínicos randomizados concluiu que o uso de VPP ou VVS para orientar o manejo de fluidos durante e/ou logo após a cirurgia foi associado a uma redução significativa na morbidade pós-operatória. No entanto, em decorrência da heterogeneidade e inconsistência entre os estudos avaliados, é necessária mais confirmação. Em pacientes de UTI clínica, nenhum ensaio clínico controlado randomizado com foco em resultados comparou ainda o manejo de fluidos baseado em PPV com o tratamento padrão.
8.
USO PRÁTICO DA VPP
Os autores apresentam um algoritmo prático para paciente está em ventilação mecânica controlada e sem arritmias afastando seu uso em pacientes em ventilação espontânea ou com arritmias (Fig. 10. Algoritmo 1).
1. Em casos de VPP > 13%, a VPP deve ter um bom valor preditivo para fluidoresponsvidade, mesmo com VC ou Crs baixos. Em caso de dúvida sobre um VPP falso-positivo (por exemplo, no contexto de disfunção do VD diagnosticada por ecocardiografia), um teste de elevação passiva das pernas (TEPP) pode ser realizado. Uma diminuição na VPP durante a elevação passiva da perna sugeriria que o paciente é realmente responsivo a fluidos, ao passo que nenhuma diminuição na VPP sugeriria que o paciente não é responsivo a fluidos e que o valor alto do VPP foi um falso positivo. A VPP se reduz em ≤-20% (valores relativos) ou em ≤-2pontos (em valores absolutos) em pacientes respondedores.
2. Em casos de VPP ≤ 9%, a VPP tem um valor preditivo excelente para não fluidoreponsividade se o VC for pelo menos 8 ml/kg e a Crs > 30 ml/kg. Em pacientes com SDRA, a interpretação pode ser mais difícil (casos falso-negativos) devido ao baixo VC ou baixa Crs. Como mencionado acima, este é um bom cenário para realizar um teste de desafio de VC aumentando transitoriamente (1 minuto) o VC (de 6 para 8 ml/kg) e medindo as mudanças absolutas da VPP. A VPP aumenta em > 20% (valores relativos) ou >1 ponto (em valor absoluto) em pacientes respondedores.
3. Alguns autores descreveram uma “zona cinzenta” para VPP (entre 9% e 13%), onde nenhuma conclusão poderia ser tirada sobre a responsividade a fluidos, mesmo quando VC for maior ou igual a 8 ml/kg. Avaliar a VPP após um desafio de VC de 8 para 12 ml/kg foi proposto para superar essa limitação. O estudo foi feito em 38 pacientes inscritos, dos quais 20 foram respondedores. O estudo mostrou que a VPP com 12ml/kg teve uma excelente previsibilidade para responsividade a fluidos com uma sensibilidade de 95% e especificidade de 72%. O cut-off ideal encontrado para VPP com 12ml/kg foi > 17%. No entanto, VPP com 8ml/kg falhou em mostrar previsibilidade significativa
Por fim, os autores destacam que a VPP não deve ser usada em casos de arritmias cardíacas e respiração espontânea. Esta última condição inclui: 1) pacientes que são intubados e ventilados com esforços respiratórios persistentes, 2) pacientes com ventilação não invasiva e 3) pacientes sem ventilação mecânica, com expiração ativa ou não. Estes cenários requerem outros testes dinâmicos de responsividade a fluidos, como elevação passiva das pernas ou testes de oclusão expiratória final.
Os autores preconizam que qualquer que seja o método utilizado, a presença de responsividade a fluidos, que é um fenômeno fisiológico, não deve levar sempre a automaticamente administrar fluidos. Apontam três situações diferentes devem ser distinguidas para a tomada de decisões (Fig.11, Algoritmo 2).
1. A decisão de iniciar a administração de fluidos em situações de urgência/emergência, na fase inicial do choque não deve ser baseada na presença de índices de responsividade a fluidos, especialmente em casos de choque séptico, sangramento ativo ou perda evidente de fluidos, considerando o risco de vida do paciente.
2. A decisão de continuar a administração de fluidos após a ressuscitação inicial é uma questão diferente, exceto em casos de sangramento ativo ou perdas de fluidos persistentes. Como nem todos os pacientes são responsivos a fluidos, os preditores de responsividade a fluidos, embora necessários, representam apenas um elemento do processo de tomada de decisão.
3. A decisão de infundir fluidos deve ser baseada na presença de três elementos: 1) sinais de choque, 2) responsividade a fluidos e 3) riscos decorrentes da sobrecarga de fluidos. Nos casos em que o edema pulmonar é um risco possível, variáveis adicionais, como a água extravascular do pulmão ou a presença de linhas B no exame de ultrassonografia pulmonar, são úteis para tomar a decisão apropriada. A decisão de descontinuar a administração de fluidos deve ser baseada na presença de apenas um dos três seguintes elementos: 1) desaparecimento dos sinais de choque, 2) aparecimento de ausência de resposta a fluidos ou 3) aparecimento de sinais de edema pulmonar.
fig. 11. algoritmo de tomada de decisões
No ambiente de cirurgia, a fluidoterapia não se limita a pacientes com choque. Durante a cirurgia de alto risco, a justificativa para a administração de fluidos é otimizar a hemodinâmica para prevenir complicações pós-operatórias. Como mencionado acima, estratégias de fluidos guiadas pela VPP (ou VVS) podem resultar em melhores resultados.
Recentemente, pesquisadores propuseram o uso da razão VPP/VVS, chamada de elastância arterial dinâmica, para prever a resposta da pressão arterial à administração de fluidos. Dois estudos clínicos sugeriram que uma relação VPP/VVS baixa prediz a ausência de resposta da pressão arterial ao fluido e, portanto, recomendariam o uso de vasopressores (valor normal entre 0.8 a 1.2). No entanto, outros estudos não conseguiram replicar esses resultados. Um estudo experimental mostrou que os vasopressores diminuem a relação VPP/VVS, questionando a recomendação de administrar vasopressores quando a relação é baixa. Alguns autores relataram que a idade é o principal determinante da razão VPP/VVS porque é maior em idosos do que em pacientes mais jovens. Portanto, deve-se ter cuidado ao interpretar a razão VPP/VVS como um indicador para iniciar a terapia vasopressora.
OBSERVAÇÕES
PESSOAIS
Em que pese à vasta revisão e opinião apresentada pelos autores de expertise indiscutível, acredito que, diante de um paciente com evidências de choque circulatório, a ressuscitação volêmica às cegas deveria ficar reservada para os casos associados a hipovolemia real (choque hipovolêmico hemorrágica, desidratação grave, perdas para o terceiro espaço). Nos demais casos, torna-se prudente avaliar antes o status volêmico e o status de fluidoresponsividade. Nos casos em que a suspeita de choque seja por vasoplegia (hipovolemia relativa) dos quais o mais comum o séptico, a despeito da existência de recomendações de administrar as cegas bolus iniciais de fluidos, como terapia inicial com bolus inicial preconizado de 30ml/kg de peso administrados numa hora (pacote atual) se faz necessário adotar cautela. Num paciente de 80 quilos de peso com ICC grave esse volume significaria 2,400ml administrados em 1 hora. Se for um paciente de 120kg o volume seria de 3,600ml. Esse paciente em razão da fisiopatologia da sepse não seria, a rigor, um paciente com perda real de volemia, mas com volemia inadequadamente redistribuída, com queda do volume estressado e do volume circulante efetivo, levando a hipoperfusão. Caso não seja mais fluidoresponsivo esse volume de 2,400ml ou 3,600ml de fluido poderá ser o suficiente para provocar sobrecarga volêmica aguda nas câmaras esquerdas e consequentemente aumento da pressão capilar pulmonar e finalmente insuficiência respiratória aguda por edema agudo de pulmão. Portanto, o prudente neste caso de suspeita de choque vasoplégico seria iniciar precocemente o uso de vasopressor simultaneamente com a ressuscitação volêmica, o que permitirá ganhar segurança quanto à possibilidade de evitar uma eventual sobrecarga volêmica.
O inicio precoce de vasopressor (norepinefrina - NE) associado à ressuscitação volêmica nos casos de choque circulatório tem sido descrito na literatura.
Em 2010, Olfa Hamzaoui e col., publicaram um estudo em que avaliaram as consequências cardíacas da administração precoce de norepinefrina em pacientes com choque séptico, internados em uma unidade de terapia intensiva de um hospital universitário. Foram incluídos 105 pacientes com choque séptico que já haviam recebido previamente reanimação volêmica. Todos receberam precocemente norepinefrina (ou aumentaram sua dose) no caso de hipotensão com risco de vida, independentemente do grau de ressuscitação de volume previa e, em particular, se a pressão arterial diastólica permanece baixa (≤40 mm Hg ou mais em caso de portadora de hipertensão) procurando atingir meta de PAM ≥ 65mmHg (ou ≥ 75mmHg se hipertenso prévio). O volume médio de solução salina infundida na UTI antes da inclusão no estudo foi de 1.000 (500 a 1.500) ml. A norepinefrina aumentou significativamente a PAM, o índice cardíaco (IC), o índice de volume sistólico (IVS), o índice de volume diastólico final global (IVDFG) e o índice de função cardíaca (IFC). Efeitos hemodinâmicos benéficos sobre IC, IVS, IVDFG e IFC foram observados em 71 pacientes com fração de ejeção ventricular esquerda ecocardiográfica basal (FEVE) > 45%, e em 34 pacientes com uma FEVE basal ≤ 45%. Nenhuma mudança no IC, IVS, IVDFG ou IFC foi observada em 17 pacientes com FEVE basal ≤ 45% para quem os valores de PAM ≥ 75 mm Hg foram alcançados com norepinefrina. Concluem os autores que a administração precoce de norepinefrina conseguiu atingir rapidamente uma pressão de perfusão suficiente em pacientes com choque séptico. Este efeito permaneceu em pacientes com baixa contratilidade cardíaca, exceto quando os valores de PAM ≥ 75 mm Hg foram alcançados[41].
Em 2014, Xiaowu Bai e col., publicaram um estudo que investigou a incidência de administração tardia de norepinefrina após o início de choque séptico e seu efeito na mortalidade hospitalar. Conduziram um estudo de coorte retrospectivo usando dados de 213 pacientes adultos com choque séptico tratados em duas unidades de terapia intensiva cirúrgica geral de um hospital terciário durante um período de dois anos. Todos os pacientes receberam ressuscitação volêmica inicial seguindo a denominada terapia precoce guiada por metas e o tratamento antimicrobiano foi administrado assim que hipoperfusão tecidual induzida por sepse foi reconhecida. Assim que os médicos julgaram que a hipotensão não respondeu à ressuscitação inicial com fluidos, terapia com vasopressor foi iniciada com o objetivo de manter a PAM em pelo menos 65 mm Hg e norepinefrina foi a primeira escolha vasopressor. O resultado primário foi a mortalidade de 28 dias. A mortalidade em 28 dias foi de 37,6% no geral. Entre os 213 pacientes, uma forte relação entre atraso na administração inicial de norepinefrina e mortalidade de 28 dias foram anotadas. O tempo médio para a norepinefrina inicial a administração foi de 3,1 ± 2,5 horas. Cada atraso de 1 hora no início da norepinefrina durante as primeiras 6 horas após o início do choque séptico foi associado a um aumento de 5,3% na mortalidade. As taxas de mortalidade de 28 dias foram significativamente maiores quando a administração de norepinefrina foi iniciada ≥ 2 horas após o início do choque séptico (NE tardia) em comparação com < 2 horas (NE precoce). As pressões arteriais médias em 1, 2, 4 e 6 horas após o início do choque séptico foram significativamente mais elevados e os níveis de lactato sérico em 2, 4, 6 e 8 horas foram significativamente mais baixos no grupo de NE precoce do que no grupo de NE tardia. A duração da hipotensão e administração de norepinefrina foi significativamente menor e a quantidade de norepinefrina administrada em um período de 24 horas foi significativamente menor para o grupo NE precoce em comparação com o grupo NE tardia. O tempo para o tratamento antimicrobiano inicial não foi significativamente diferente entre o grupo de NE precoce e o grupo de NE tardia. Concluem os autores que a administração precoce de norepinefrina em pacientes com choque séptico está associada a um aumento da taxa de sobrevida[42].
Em 2017, Olfa Hamzaoui e col., publicaram uma revisão na qual apontam que por décadas, a ressuscitação do choque séptico usou administração de fluidos antes do início dos vasopressores, que foram administrados apenas quando a fluidoterapia foi incapaz de restaurar a pressão artéria media. Entretanto salientam que, considerando os mecanismos do choque séptico, no qual a hipotensão se deve a depressão do tônus vascular (vasoplegia) seria improvável que o mesmo possa ser corrigido apenas com a administração de fluidos. Citam dados da literatura a favor do início precoce de vasopressores durante o choque séptico, a fim de evitar hipotensão severa e persistente, que é fator independentemente associado com aumento mortalidade. Apontam que pacientes que recebem norepinefrina administrada dentro das primeiras 2 horas de ressuscitação (precoce) recebem menos líquidos que aqueles que recebem norepinefrina de forma tardia. No entanto, o inicio de vasopressores de forma precoce para neutralizar a depressão do tônus vasomotor não implica na descontinuação da infusão de fluidos. A este respeito, uma sistemática e deliberada estratégia de fluido restritiva não faria sentido porque às vezes pode ter efeitos deletérios de longo prazo, apesar de curto prazo de efeitos benéficos. Enfatizam a necessidade de individualizar o manejo de fluidos durante o choque séptico avaliando a fluidoresponsividade para evitar tanto uma estratégia demasiado restritiva ou demasiado liberar de administração de fluidos. Uma pressão arterial diastólica baixa (como um marcador de tônus vascular deprimido) é uma ferramenta simples para identificar pacientes sépticos que precisam de norepinefrina com urgência. O alvo ideal da pressão arterial média deve ser individualizado durante a ressuscitação do choque séptico. Embora 65 mmHg seja a média geralmente recomendada de alvo de pressão arterial, algumas condições, como história de hipertensão crônica pode exigir uma PAM maior do que 65 mmHg a serem alcançados[43].
Em 2020, Olfa Hamzaoui e col., publicaram nova revisão de estudos mais recentes reafirmando que a administração precoce de norepinefrina (NE) pode permitir atingir a meta de pressão arterial média (PAM) inicial mais rapidamente e reduzir o risco de sobrecarga hídrica. A pressão arterial diastólica (PAD) como marcador do tônus vascular, ajudaria a identificar os pacientes que precisam de NE com urgência. Os dados disponíveis sugerem uma PAM de 65 mmHg como o alvo inicial, mas uma abordagem mais individualizada é frequentemente necessária, dependendo de vários fatores, como histórico de hipertensão crônica ou valor da pressão venosa central (PVC). Em casos de hipotensão refratária, o aumento da NE ≥1 μg/kg/min pode ser uma opção. No entanto, as diretrizes dos especialistas atuais sugerem combinar NE com outros vasopressores, como vasopressina, com a intenção de aumentar a PAM para atingir ou diminuir a dosagem de NE[44].
Portanto, o uso de métodos ou marcadores preditores de fluidoresponsividade torna-se de muita relevância no cenário do paciente grave/crítico.
A VPP (ou ΔPP) é uma ferramenta de utilidade indiscutível nos moldes e parâmetros em que foram descritos no estudo original de Frederick Michard e col., tomando como referência o cut-off de 13%. Entretanto, para pacientes ventilados com VC baixo e, de acordo com as mais recentes metanálise publicadas, deve se adotar uma cut-off de 10%.
Nos cenários nos quais o viés de aferição pode estra presente, a avaliação multimodal usando vários marcadores de fluidoresponsividade torna-se mandatória. Associar os resultados da VPP com os de outros marcadores tornará mais segura a tomada de decisões. Esta avaliação multimodal já seria recomendada mesmo nos cenários em que o risco de viés for mínimo.
Não resta dúvida que se houver disponibilidade de aferir débito cardíaco seja de forma intermitente ou contínua, seria o método ideal para avaliar fluidoresponsividade, considerando a variação de 10 a 15% após uma prova de volume ou um teste de elevação passiva das pernas. Entretanto, sabe-se que grande parte das UTIs brasileiras não disponibilizam sequer de um sistema de aferição de débito cardíaco, mesmo sendo exigência da legislação sanitária em vigor para o funcionamento de tais unidades. E, mesmo que houver um sistema para cumprir com a exigência sanitária, faltaria para outros pacientes que porventura vierem precisar de forma simultânea.
Portanto, importante saber usar e otimizar os recursos com os que se contam em cada unidade.
A última metanálise publicada recentemente em fevereiro de 2021 pelo grupo colombiano de Alvarado S. Jorge e col., em paciente sob ventilação mecânica controlada, em VCV com VC baixo (≤ 8ml/kg) sem arritmias, pode representar um auxilio importante considerando os marcadores avaliados e os pontos de corte encontrados acima dos quais define-se paciente respondedor ou fluidoresponsivo:
- Variação da pressão de pulso (VPP): ≥ 10%
- Variação do volume sistólico (VVS): ≥ 12%
- Teste de oclusão expiratória final (TOEF): ≥ 5%
- Teste de elevação passiva das pernas (TEPP): ≥ 13%
- Índice de distensibilidade da VCI (IDVCI):≥ 16%
- Desafio com minifluido (DMF): ≥ 1%
- Teste de desafio de volume corrente (TDVC): ≥ 3
Deveremos aguardar novos estudos que tragam maior força de evidência que permitam otimizar ainda mais o uso destes marcadores de fluidoresponsividade.
[1]
Marik, P.E., X. Monnet, and J.L. Teboul,
Hemodynamic parameters to guide fluid therapy. Ann Intensive Care, 2011. 1(1):
p. 1.
[2]
Michard, F. and J.L. Teboul, Predicting fluid responsiveness in ICU patients: a
critical analysis of the evidence. Chest, 2002. 121(6): p. 2000-8.
[3]
Sharma R, Sharma S. Physiology, Blood Volume. [Updated 2020 Apr 25]. In: StatPearls
[Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan-. Available
from: https://www.ncbi.nlm.nih.gov/books/NBK526077/
[4] Nadler SB, Hidalgo JH, Bloch
T. Prediction of blood volume in normal human adults. Surgery. 1962
Feb;51(2):224-32. [PubMed] [Reference list]
[5] Lemmens HJ, Bernstein DP,
Brodsky JB. Estimating blood volume in obese and morbidly obese patients. Obes
Surg. 2006 Jun;16(6):773-6. [PubMed] [Reference list]
[6]
Guyton e Hall. Tratado de Fisiologia Médica. Tradução da 13ª Edição 2017.
Capítulo 14.
[7] Biondi JW, et al: The effect
of incremental positive end expiratory pressure on right ventricular haemodynamics
and ejection fraction. Anesth Analg 67:144, 1988
[8] Perner, A. and D. De Backer,
Understanding hypovolaemia. Intensive Care Med, 2014. 40(4): p. 613-5.
[9] Stetz CW, Miller RG, Kelly
GE, Raffin TA. Reliability of thermodilution method in the determination of
cardiac output in clinical practice. Am Rev Respir Dis. 1982;126(6):1001-4
[10] Diebel LN, Wilson RF, Tagett
MG, et al. End-diastolic volume: a better indicator of preload in the
critically ill. Arch Surg 1992; 127:817–822
[11] Michard F, Teboul JL.
Predicting fluid responsiveness in ICU patients: a critical analysis of the
evidence. Chest. 2002 Jun;121(6):2000-8. doi: 10.1378/chest.121.6.2000. PMID:
12065368.
[12]
Guyton AC. Determination of cardiac output by equating venous return curves
with cardiac response curves. Physiol Rev. 1955;35:123–9. [PubMed] [Google
Scholar]
[13] Constanzo
S. Linda. Fisiologia. 4ª edição em espanhol. 2011.
[14]
Spiegel R. (2016). Stressed vs. unstressed volume and its relevance to critical
care practitioners. Clinical and experimental emergency medicine, 3(1), 52–54.
https://doi.org/10.15441/ceem.16.128
[15] Perner, A. and D. De Backer,
Understanding hypovolaemia. Intensive Care Med, 2014. 40(4): p.
613-5.
[16] Ostermann, M., Hall, A.,
& Crichton, S. (2017). Baixa pressão média de perfusão é um
fator de risco para progressão da lesão renal aguda em pacientes críticos - Uma
análise retrospectiva. BMC nephrology , 18 (1), 151.
https://doi.org/10.1186/s12882-017-0568-8
[17] Bruce M. Koeppen MD, PhD,
Bruce A. Stanton PhD, in Renal Physiology (Fifth Edition), 2013
[18] Michard F, Teboul JL.
Predicting fluid responsiveness in ICU patients: a critical analysis of the
evidence. Chest 2002;121:2000–2008. r
[19] Vincent JL, Sakr Y, Sprung
CL, Ranieri VM, Reinhart K, Gerlach H, et al.; Sepsis Occurrence in Acutely Ill
Patients Investigators. Sepsis in European intensive care units:
results of the SOAP study. Crit Care Med 2006;34:344–353.
[20]
Monnet X, Marik PE, Teboul JL. Prediction of fluid responsiveness: an update.
Ann Intensive Care 2016;6:111.
[21]
Jardin F, Farcot JC, Gueret P, Prost JF, Ozier Y, Bourdarias JP. Cyclic changes
in arterial pulse during respiratory support. Circulation 1983;68:266–274.
[22]
Robotham JL, Cherry D, Mitzner W, Rabson JL, Lixfeld W, Bromberger-Barnea B. A
re-evaluation of the hemodynamic consequences of intermittent positive pressure
ventilation. Crit Care Med 1983;11:783–793.
[23]
Pinsky MR. The influence of positive-pressure ventilation on cardiovascular
function in the critically ill. Crit Care Clin 1985;1:699–717.
[24]
Michard F, Teboul JL. Using heart-lung interactions to assess fluid
responsiveness during mechanical ventilation. Crit Care 2000;4:282–289.
[25]
Vieillard-Baron A, Loubieres Y, Schmitt JM, Page B, Dubourg O, Jardin F. Cyclic
changes in right ventricular output impedance during mechanical ventilation. J
Appl Physiol (1985) 1999;87:1644–1650.
[26]
Michard F, Teboul JL. Using heart-lung interactions to assess fluid
responsiveness during mechanical ventilation. Crit Care 2000;4:282–289.
[27]
Monnet X, Marik PE, Teboul JL. Prediction of fluid responsiveness: an update.
Ann Intensive Care 2016;6:111.
[28]
Marik PE, Cavallazzi R, Vasu T, Hirani A. Dynamic changes in arterial waveform
derived variables and fluid responsiveness in mechanically ventilated patients:
a systematic review of the literature. Crit Care Med 2009;37:2642–2647.
[29]
Yang X, Du B. Does pulse pressure variation predict fluid responsiveness in
critically ill patients? A systematic review and meta-analysis. Crit Care
2014;18:650.
[30]
Chemla D, Hébert JL, Coirault C, Zamani K, Suard I, Colin P, et al. Total
arterial compliance estimated by stroke volume-to-aortic pulse pressure ratio
in humans. Am J Physiol 1998;274:H500–H505.
[31] Michard F, Chemla D, Richard
C, Wysocki M, Pinsky MR, Lecarpentier Y, et al. Clinical use of respiratory
changes in arterial pulse pressure to monitor the hemodynamic effects of PEEP.
Am J Respir Crit Care Med 1999;159:935–939.
[32] Michard F, Boussat S, Chemla
D, Anguel N, Mercat A, Lecarpentier Y, et al. Relation between respiratory
changes in arterial pulse pressure and fluid responsiveness in septic patients
with acute circulatory failure. Am J Respir Crit Care Med 2000;162:134–138.
[33] Magder S, Guerard B.
Heart-lung interactions and pulmonary buffering: lessons from a computational
modeling study. Respir Physiol Neurobiol 2012;182:60–70.
[34] Marik PE, Cavallazzi R, Vasu
T, Hirani A. Dynamic changes in arterial waveform derived variables and fluid
responsiveness in mechanically ventilated patients: a systematic review of the
literature. Crit Care Med 2009;37:2642–2647.
[35]
Michard F, Chemla D, Teboul JL. Applicability of pulse pressure variation: how
many shades of grey? Crit Care 2015;19:144.
[36]
Marik PE, Cavallazzi R, Vasu T, Hirani A. Dynamic changes in arterial waveform
derived variables and fluid responsiveness in mechanically ventilated patients:
a systematic review of the literature. Crit Care Med 2009;37:2642–2647.
[37]
Jean-Louis Teboul, Xavier Monnet, Denis Chemla
and Frédéric Michard. Arterial Pulse Pressure Variation with Mechanical
Ventilation. American Journal of Respiratory and Critical Care Medicine. Volume
199, Issue 1. Janeiro 2019. https://doi.org/10.1164/rccm.201801-0088CI
[38]
Alvarado Sánchez JI, Caicedo Ruiz JD, Diaztagle Fernández JJ, Ospina-Tascón GA,
Cruz Martínez LE. Use of Pulse Pressure Variation as Predictor of Fluid
Responsiveness in Patients Ventilated With Low Tidal Volume: A Systematic
Review and Meta-Analysis. Clinical Medicine Insights: Circulatory, Respiratory
and Pulmonary Medicine. January 2020. doi:10.1177/1179548420901518
[39]
Alvarado Sánchez, J.I., Caicedo Ruiz, J.D., Diaztagle Fernández, J.J. et al.
Predictors of fluid responsiveness in critically ill patients mechanically
ventilated at low tidal volumes: systematic review and meta-analysis. Ann.
Intensive Care 11, 28 (2021). https://doi.org/10.1186/s13613-021-00817-5
[40]
Taccheri, T., Gavelli, F., Teboul, JL. et al. Do changes in pulse pressure
variation and inferior vena cava distensibility during passive leg raising and
tidal volume challenge detect preload responsiveness in case of low tidal
volume ventilation?. Crit Care 25, 110 (2021).
https://doi.org/10.1186/s13054-021-03515-7
[41]
Hamzaoui O, Georger JF, Monnet X, Ksouri H, Maizel J, Richard C, Teboul JL. Early administration of
norepinephrine increases cardiac preload and cardiac output in septic patients
with life-threatening hypotension. Crit Care. 2010;14(4):R142. doi:
10.1186/cc9207. Epub 2010 Jul 29. PMID: 20670424; PMCID: PMC2945123.
[42] Bai, X., Yu, W., Ji, W. et
al. Early versus delayed administration of norepinephrine in patients with
septic shock. Crit Care 18, 532 (2014). https://doi.org/10.1186/s13054-014-0532-y
[43]
Hamzaoui O, Scheeren TWL, Teboul JL. Norepinephrine in septic shock: when and
how much? Curr Opin Crit Care. 2017 Aug;23(4):342-347. doi:
10.1097/MCC.0000000000000418. PMID: 28509668.
[44]
Shi, R., Hamzaoui, O., De Vita, N., Monnet, X., & Teboul, J. L. (2020).
Vasopressors in septic shock: which, when, and how much?. Annals of
translational medicine, 8(12), 794. https://doi.org/10.21037/atm.2020.04.24











Nenhum comentário:
Postar um comentário