PNEUMONIA POR STENOTROPHOMONAS
MALTOPHILIA, UM DIAGNÓSTICO QUE DEVE SER CONSIDERADO NA UNIDADE DE TERAPIA
INTENSIVA. UMA REVISÃO BASEADA NO UPTODATE[1]
*Dr. Alejandro Enrique Barba Rodas. Médico Intensivista. Coordenador da Unidade Coronariana da Santa Casa de São Jose dos Campos.
I. INTRODUÇÃO
STENOTROPHOMONAS MALTOPHILIA
é um germe, hoje considerado como PATÓGENO NOSOCOMIAL OPORTUNISTA EMERGENTE,
particularmente entre pacientes hospitalizados, gravemente
imunocomprometidos e debilitados; relacionado a infecções respiratórias, de
corrente sanguíneo, associadas a cateter, pele e tecidos moles; com alta
morbidade e mortalidade que pode chegar até 69%. Apresenta ampla RESISTÊNCIA
INTRÍNSECA com atividade in vitro limitada a drogas como sulfametoxazol/trimetoprima,
fluoroquinolonas, tetraciclinas, ceftazidima e polimixinas [1].
II. MICROBIOLOGIA
S. maltophilia é um bacilo
gram-negativo aeróbico obrigaório, móvel, oxidase-negativa e catalase-positiva,
não fermentador de lactose, que cresce bem em meios laboratoriais comumente
usados, incluindo sangue e ágar Mac Conkey. Foi isolado pela primeira vez em
1943 e, na época, foi chamado de Bacterium bookeri. Posteriormente, foi
classificado dentro do gênero Pseudomonas, depois Xanthomonas e,
finalmente, Stenotrophomonas, em 1993. O nome Stenotrophomonas
maltophilia deriva de dois termos com raízes gregas. Stenotrophomonas, significa
"uma unidade alimentando-se de poucos substratos", com base nas
raízes gregas stenos (estreitas), trophos (uma que se alimenta) e
monas (uma unidade). Maltophilia, significa "afinidade pelo
malte", baseada nas raízes gregas maltum (malte) e philia
(afinidade). S. maltophilia é a única espécie de Stenotrophomonas conhecida por
infectar humanos, enquanto seus parentes genéticos mais próximos são patógenos
de plantas. É frequentemente isolado do solo, água, animais, matéria vegetal e
equipamentos hospitalares com capacidade inerente de adesão e formação de
biofilme, protegendo-se contra as defesas do hospedeiro, bem como de agentes
antimicrobianos. Fatores que contribuem para esse comportamento incluem sua
superfície positivamente carregada e adesões fimbriais. Daí que sempre foi
considerado, GERME CONTAMINANTE/COLONIZANTE.
Além disso, a S. maltophilia
possui mecanismos de resistência intrínseca ou adquirida a várias classes de
antibióticos. A resistência aos beta-lactâmicos é conferida por duas
beta-lactamases induzíveis, uma penicilinase contendo zinco (L1) e uma
cefalosporinase. Uma aminoglicosídeo acetiltransferase confere resistência aos
antibióticos aminoglicosídeos. Mudanças dependentes da temperatura na estrutura
do lipopolissacarídeo (LPS) da membrana externa têm sido associadas à adição de
resistência a antibióticos aminoglicosídeos. Além disso, muitas cepas de S.
maltophilia possuem bombas de efluxo, que conferem maior resistência a
múltiplas classes de drogas antibacterianas.
III. EPIDEMIOLOGIA
A incidência relatada de
infecções por S. maltophilia varia de 7.1 a 37.7 casos por 10.000 descargas. A
incidência parece estar aumentando à medida que a população de pacientes em
risco aumenta. Este aumento é provavelmente devido a avanços no tratamento de
malignidade, aumento do uso de dispositivos invasivos e uso generalizado de
antibióticos de amplo espectro.
IV. FATORES DE RISCO
Os fatores de risco associados
à infecção por S. maltophilia incluem internação em unidade de terapia
intensiva (UTI), infecção por HIV, malignidade, fibrose cística, neutropenia,
ventilação mecânica, dispositivos invasivos (principalmente cateteres venosos
centrais), cirurgia recente, trauma e terapia prévia com antibióticos de amplo
espectro.
As infecções por S. maltophilia
são tipicamente adquiridas em hospitais. Mesmo em infecções adquiridas na
comunidade, os indivíduos mais afetados têm exposição significativa à saúde ou
comorbidades predisponentes (por exemplo, trauma anterior, condição de
comprometimento imunológico, dispositivos internos).
V. ASSOCIAÇÕES COM DOENÇAS
PNEUMONIA E BACTEREMIA são as
manifestações mais comuns da infecção.
Infecção pulmonar - A
pneumonia por S. maltophilia geralmente é adquirida no hospital (PAH) e ocorre
mais frequentemente em pacientes sob ventilação mecânica (PAV). Em comparação
com a colonização pulmonar, a infecção está associada à imunossupressão
subjacente. Os achados clínicos e radiográficos são geralmente semelhantes aos
observados com outras causas infecciosas de pneumonia hospitalar. No entanto,
em pacientes com neoplasias hematológicas, uma síndrome de pneumonia hemorrágica
rapidamente progressiva e frequentemente fatal associada à infecção por S.
maltophilia tem sido cada vez mais relatada[2].
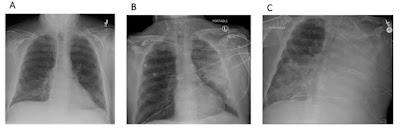
Progressão da radiografia de tórax em paciente com pneumonia
hemorrágica por S. maltophilia. A: Raio X de tórax portátil na admissão. B:
Raio-X torácico portátil pós-intubação, 36 horas após admissão no hospital. C: Raio-X
portátil de tórax 72 horas após a internação hospitalar.
S. maltophilia é um patógeno
reconhecido em pacientes com fibrose cística nos Estados Unidos, com taxas de
prevalência global semelhantes às das micobactérias não tuberculosas. A
infecção por S. maltophilia correlaciona-se com o declínio da função pulmonar
em pacientes adultos e pediátricos com fibrose cística; no entanto, a
causalidade não foi determinada.
Bacteremia - A maioria dos
casos de bacteremia por S. maltophilia está associada a cateteres de vasculares.
Como exemplo, em um estudo de 207 pacientes oncológicos com cateter venoso
central e infecção da corrente sanguínea por S. maltophilia, 73% das infecções
foram consideradas relacionadas ao cateter (ICS-CVC), 22% eram secundárias
(principalmente de origem pulmonar) e 5% foram consideradas primárias e não
relacionado ao cateter. A recaída de bacteremia associada a cateter, mesmo até
200 dias após o tratamento da infecção inicial, também é descrita e tem sido
associada com neutropenia prolongada e permanência do cateter. Outras fontes de
bacteremia incluem o trato gastrointestinal ou mucosite grave em pacientes com
neutropenia severa.
Outras manifestações -
Manifestações menos comuns de infecções por S. maltophilia incluem endocardite,
mastoidite, peritonite, meningite, infecção de partes moles, infecção de
ferida, infecção do trato urinário e infecção ocular. As Stenotrophomonas
também podem causar manifestações cutâneas, que podem refletir infecção
metastática ou infiltração local. Manifestações cutâneas relatadas incluem
celulite, úlceras infectadas e ectima gangrenoso. Um número de focos de S.
maltophilia foram descritos envolvendo pacientes de UTI adulto, malignidades
hematológicas e de medula óssea receptores de transplantes, os pacientes de
hemodiálise, e neonatos. A exposição do paciente à água da torneira contaminada
tem sido a etiologia suspeita em muitos surtos. Além disso, vários surtos e
pseudo-surtos foram associados a falhas no reprocessamento do endoscópio.
VI. DIAGNÓSTICO DA INFECÇÃO
S. maltophilia pode ser
prontamente identificada na cultura de amostras coletadas. O crescimento de S.
maltophilia a partir de locais normalmente estéreis (como sangue ou líquido
peritoneal) deve ser interpretado como representando uma infecção verdadeira.
No entanto, como a S. maltophilia pode aderir às superfícies mucosas das vias
aéreas superiores e dos grandes brônquios e colonizar essas áreas sem causar
infecção, é importante diferenciar a colonização da infecção verdadeira
causada por S. maltophilia, particularmente de isolados respiratórios. Em
pacientes com evidência clínica, laboratorial e radiológica de pneumonia (por
exemplo, novo infiltrado pulmonar, diminuição da oxigenação, febre e/ou
leucocitose), culturas positivas de S. maltophilia (com ou sem outros patógenos
respiratórios concomitantes) de locais respiratórios devem ser interpretadas como
infecção. Na ausência de consolidação na radiografia de tórax e outros sinais
clínicos de infecção pulmonar, um isolado positivo do trato respiratório de
Stenotrophomonas provavelmente representa colonização em vez de infecção. Em
uma revisão retrospectiva de 92 pacientes que apresentavam sintomas
respiratórios agudos e subsequentemente encontraram culturas respiratórias positivas
para S. maltophilia, não houve impacto mensurável da antibioticoterapia na
ausência de consolidação radiológica de tórax. Além disso, os médicos devem ter
cautela ao interpretar dados de cultura obtidos de locais não estéreis, como
cateteres urinários internos, drenos cirúrgicos e centros de cateteres
vasculares, dada a propensão do organismo a colonizar esse tipo de dispositivos.
Nessas situações, a avaliação de evidências clínicas de infecção (por exemplo,
febre, leucocitose, dor localizada etc.) é fundamental. Na ausência de
bacteremia ou evidência de infecção em outros locais estéreis (como líquido
pleural, líquido peritoneal), esses achados de cultura podem ser considerados
como refletindo colonização em vez de infecção.
VII. TRATAMENTO
Indicações - As infecções
por S. maltophilia devem ser tratadas com antibióticos imediatamente, já que o
atraso no tratamento adequado pode contribuir para uma mortalidade
significativa. Se o isolamento de S. maltophilia sugere infecção verdadeira, em
vez de colonização, deve se iniciar tratamento. Pelo contrário, colonização não
deve ser tratada e o uso inapropriado de antibióticos contribui para efeitos
adversos adicionados e seleção para organismos resistentes. Nos casos em que a
distinção entre infecção e colonização for incerta (por exemplo, em um paciente
que é conhecido por ter colonização das vias aéreas por S. maltophilia e
subsequentemente desenvolve evidência clínica de pneumonia), recomenda-se o
início do tratamento. Após 48 a 72 horas, deve se reavaliar a necessidade de
manter ou suspender o tratamento a depender da evolução clínica e dados
laboratoriais. Normalmente não se inclui cobertura para S. maltophilia no
tratamento empírico de pneumonia ou sepse em pacientes críticos
imunocomprometidos sem evidência prévia de colonização por S. maltophilia.
Eficácia das opções de antibióticos
- A S. maltophilia é um organismo
intrinsecamente multirresistente, portanto, as opções de antibióticos são
limitadas e os dados clínicos são limitados em relação à terapia ideal.
O trimetoprim-sulfametoxazol
(TMP-SMX) é o tratamento de escolha, pois tem a atividade in vitro mais
confiável contra S. maltophilia. Como exemplo, em um estudo de vigilância de
organismos gram-negativos isolados de pacientes hospitalizados com pneumonia
entre 2009 e 2012, a suscetibilidade ao TMP-SMX foi documentada em 96 % dos
302 isolados de S. maltophilia dos hospitais dos Estados Unidos e 98% dos 192
isolados de hospitais europeus. Além disso, estudos observacionais e séries de
casos relatam desfechos clínicos favoráveis quando o TMP-SMX é usado. No
entanto, alguns pacientes são incapazes de tolerar TMP-SMX devido à reação de
hipersensibilidade, toxicidade de drogas ou outras reações adversas. Além
disso, a resistência in vitro ao TMP-SMX entre isolados de S. maltophilia tem
sido cada vez mais relatada, particularmente em pacientes com fibrose cística.
As fluoroquinolonas, em
particular a levofloxacina, são alternativas potenciais ao TMP-SMX. No estudo
de vigilância discutido acima, 75 a 84% dos isolados pulmonares de S.
maltophilia eram suscetíveis à levofloxacina. Além disso, pequenos estudos
retrospectivos sugeriram resultados clínicos semelhantes (cura microbiológica,
sucesso clínico e menores taxas de mortalidade de curto prazo) na infecção por
S. maltophilia com fluoroquinolona versus monoterapia com TMP-SMX. No entanto,
estudos in vitro levantam a preocupação sobre a potencial seleção de mutantes
resistentes durante o tratamento com fluoroquinolonas. Embora os dados sugiram
que a moxifloxacina pode ter atividade in vitro semelhante à levofloxacina
contra S. maltophilia, sugere-se preferir a levofloxacina em vez da
moxifloxacina para o tratamento de infecções por S. maltophilia.
A minociclina e a tigeciclina
também apresentam baixas concentrações inibitórias mínimas entre os isolados de
S. maltophilia, e cada uma delas demonstrou, em pequenos estudos
retrospectivos, estar associada a resultados clínicos comparáveis àqueles com
TMP-SMX. No entanto, baixos níveis séricos da tigeciclina, limitam a sua
utilidade para infecções da corrente sanguínea, e preocupações com taxas de
mortalidade mais altas associadas à tigeciclina comparados com outros agentes
para tratamento de pneumonia diminuem o entusiasmo por esse agente.
A associação ticarcilina-ácido clavulânico,
foi proposta como uma terapia alternativa, embora as taxas de resistência in
vitro sejam de 55%. As taxas de resistência à ceftazidima também são
relativamente altas. As polimixinas (por exemplo, sulfato de colistina) têm
taxas variáveis de atividade in vitro contra S. maltophilia.
Caso, a S. maltophilia apresenta
altas taxas de resistência, por mecanismos intrínsecos ou adquiridos, a outros
beta-lactâmicos, aztreonam, aminoglicosídeos, fosfomicina, a resistência aos
carbapenêmicos deve ser presumida, independentemente dos resultados do teste de
suscetibilidade.
Monoterapia (MT) versus
Terapia Combinada (TC) - Devido às altas taxas de resistência a muitas
classes de antibióticos, tem havido interesse no potencial de atividade
sinérgica com regimes de terapia combinada. Até agora, os dados clínicos sobre
o benefício da terapia combinada são limitados e, portanto, seu papel permanece
incerto. Em um estudo prospectivo de pacientes com bacteremia por S.
maltophilia, a administração de dois ou mais drogas como TMP-SMX, uma
cefalosporina de terceira geração e uma penicilina de espectro estendido
associaram-se a menores taxas de mortalidade comparadas ao recebimento de
apenas uma. A evidência para terapia combinada reside predominantemente em
estudos in vitro. Vários relataram sinergismo in vitro para várias combinações
de antibióticos, incluindo TMP-SMX mais ceftazidima, TMP-SMX mais ticarcilina-ácido
clavulânico e ticarcilina-clavulânico mais ciprofloxacina. O debate entre
terapia combinada (TC) e monoterapia (MT) continua apesar da falta de
comparações de dados clínicos. Alguns especialistas preferem TC para sinergia
ou para prevenir desenvolvimento de resistência, uma vez que a MT poderia ser
inadequada[3]
[4]
[5]
[6]
[7]
[8].
Estudos em humanos tem mostrado falhas no tratamento e desenvolvimento de
resistência com MT a base de trimetoprim/sulfametoxazol, minociclina ou
fluoroquinolona[9] [10]
[11].
Outro estudo revelou menor mortalidade em pacientes com bacteremia por S.
maltophilia tratados com TC versus MT ou nenhum agente[12].
As evidências clínicas que apoiam o uso de TC em infecções do trato
respiratório por S. maltophilia são limitadas, já que a maioria dos estudos de
eficácia excluíram a TC.
Estudo americano retrospectivo recentemente
publicado avaliou pacientes admitidos entre novembro de 2011 e outubro 2017 com
pneumonia por S. maltophilia que receberam, pelo menos 48 h de terapia eficaz,
avaliando como desfecho primário a resposta clínica após 7 dias de terapia
efetiva com TC versus MT. Os resultados secundários incluíram desenvolvimento de
um isolado não suscetível, cura microbiológica de 30 dias, recorrência da
infecção, mortalidade relacionada e mortalidade por todas as causas. Dos 252 pacientes com pneumonia causada por S.
maltophilia, 38 receberam TC e 214 receberam TM. TC apresentou taxas
semelhantes de eficácia clínica e desenvolvimento de resistência em comparação
com MT[13].
Abordagem da seleção de
antibióticos - o TMP-SMX (administrado como 15 mg/kg/dia do
componente TMP em três ou quatro doses divididas, ajustado para a função renal,
é o tratamento de escolha, e geralmente o usamos como terapia empírica (isto
é, antes dos resultados das culturas e antibiograma) e como terapia dirigida
(se o isolado for suscetível) de infecções por S. maltophilia . Para terapia
empírica de infecções por S. maltophilia em pacientes gravemente doentes,
pacientes com neutropenia ou outra condição imunocomprometedora, e pacientes
com sinais e sintomas persistentes apesar da terapia aparentemente apropriada,
sugere-se a adição de um segundo agente ativo (por exemplo, levofloxacina ou
ceftazidima com base em antibiograma local e fatores do paciente, como
alergias) até que os resultados de suscetibilidade sejam conhecidos.
Para pacientes que não podem usar
o TMP-SMX devido a hipersensibilidade ou outra toxicidade esperada, usamos
levofloxacina ou ceftazidima, novamente com base no conhecimento do
antibiograma local e de fatores específicos do paciente, como alergias e/ou
necessidade de cobertura de patógenos adicionais, por terapia empírica. Se o
isolado for suscetível à levofloxacina, é apropriado continuar com a
levofloxacina como terapia direcionada de S. maltophilia, particularmente se
houver uma infecção polimicrobiana e se a levofloxacina estiver tratando outros
patógenos identificados. Se o isolado for suscetível a outros beta-lactâmicos (como
ticarcilina-clavulanato ou ceftazidima), estas também são alternativas
razoáveis se o TMP-SMX não puder ser usado.
Se o isolado for suscetível ao
TMP-SMX, mas não às fluoroquinolonas ou a quaisquer beta-lactâmicos,
favorecemos a dessensibilização rápida para pacientes que tenham uma reação de
hipersensibilidade mediada por imunoglobulina “E” ao TMP-SMX, Caso contrário,
alternativas potenciais incluem minociclina , tigeciclina e colistina, cada uma
das quais está associada a efeitos adversos específicos.
Duração da terapia - A
duração da terapia depende do local da infecção. 14 dias de terapia é
apropriada para bacteremia e 7 dias de terapia é apropriada para pneumonia
hospitalar em um hospedeiro imunocompetente, desde que haja evidência de
melhora clínica. Durações mais longas da terapia (10 a 14 dias) são
frequentemente usadas em hospedeiros imunocomprometidos.
Outras questões de manejo -
Além do tratamento antimicrobiano, certas infecções podem exigir intervenções
adicionais, como remoção de dispositivos invasivos ou desbridamento de feridas.
Como exemplo, para infecções da corrente sanguínea associadas ao cateter, a
remoção do cateter é importante na redução da taxa de recidiva.
VIII. PROGNÓSTICO
infecções por S. maltophilia têm
sido associadas com alta morbidade e mortalidade em indivíduos gravemente
imunocomprometidos e debilitados. No geral, as estimativas de mortalidade
variam de 21 a 69%. No entanto, a mortalidade real atribuída a essas infecções
ao controlar outras variáveis não é clara. Análises retrospectivas têm
buscado identificar fatores de risco independentes associados à mortalidade em
pacientes infectados com S. maltophilia. Em um estudo de coorte retrospectivo,
a internação em unidade de terapia intensiva e o atraso no tratamento efetivo
foram considerados fatores de risco independentes para mortalidade.
IX. PREVENÇÃO
As medidas de controle de
infecção e de administração de antibióticos são importantes para minimizar a
incidência de infecções por S. maltophilia e para reduzir o surgimento de cepas
resistentes. Essas medidas incluem o uso apropriado de antibióticos, evitar o
uso prolongado ou desnecessário de dispositivos invasivos e a adesão às
práticas de higienização das mãos. Procedimentos rígidos de higiene das mãos e
isolamento de contato têm sido utilizados para reduzir a disseminação clonal no
ambiente da unidade de terapia intensiva.
Importante estar atentos a
eventuais surtos de infecção, principalmente respiratória, por S. maltophilia.
Em 2008 foi publicado um estudo brasileiro de um surto de pneumonia por S.
maltophilia na UTI do Instituto de Infectologia Emílio Ribas ocorrido no ano de
2007, através de um estudo caso-controle. Os casos foram todos pacientes com pneumonia
associada à ventilação mecânica com o isolamento de S. maltophilia no material
de secreção traqueal. Os controles foram os pacientes maiores de 18 anos, submetidos
à ventilação mecânica por pelo menos cinco dias e que não desenvolveram
pneumonia hospitalar. Foram encontrados 11 casos e 21 controles. O uso de três
ou mais antibióticos (p=0,05) e de piperacilina/tazobactam (p=0,03) foi associado
com o desenvolvimento de pneumonia por S. maltophilia. A mortalidade dos casos
foi de 100%, o tempo médio entre a coleta de material e início de tratamento
específico para o agente foi de 4,8 dias. A resistência ao sulfametoxazol/trimetoprim
foi de 18% (duas de 11 amostras). O surto foi controlado com medidas simples
como isolamento dos doentes, revisão das práticas de limpeza e desinfecção do
material de terapia respiratória, medidas educativas e de sensibilização com as
equipes médica, de enfermagem e de fisioterapia. Este estudo concluiu que no
caso de paciente imunossuprimido, já exposto a antibióticos de largo espectro
para germes usuais de infecção hospitalar, que evolui com deterioração clínica,
sugere-se iniciar tratamento empírico para S. maltophilia. Além disso, ressalta-ses
a importância do cumprimento das medidas fundamentais de controle e prevenção
de infecção hospitalar e o uso racional de antimicrobianos, para que possa se
evitar e controlar uma situação de surto[14].
· Stenotrophomonas maltophilia é um bacilo
gram-negativo multirresistente considerado patógeno oportunista associado com alta
morbidade e mortalidade em indivíduos
É frequentemente isolado do solo, água, animais,
matéria vegetal e coloniza equipamentos hospitalares com capacidade inerente de
adesão e formação de biofilme de dispositivos invasivos, protegendo-se contra
as defesas do hospedeiro, bem como de agentes antimicrobianos em pacientes gravemente
imunocomprometidos e debilitados.
·
Os fatores de risco associados à infecção por
Stenotrophomonas incluem admissão em uma unidade de terapia intensiva, infecção
por HIV, malignidade, fibrose cística, neutropenia, ventilação mecânica,
cateteres venosos centrais, cirurgia recente, trauma e terapia prévia com
antibióticos de amplo espectro.
·
Pneumonia (geralmente adquirida no hospital) e
bacteremia (geralmente associada a um cateter de demora) são as manifestações
mais comuns da infecção por S. maltophilia. Manifestações menos comuns incluem
endocardite, mastoidite, peritonite, meningite, infecção dos tecidos moles,
infecção da ferida, infecção do trato urinário e infecção ocular.
·
O crescimento de S. maltophilia a partir de
locais normalmente estéreis (como sangue ou fluido peritoneal) deve ser
interpretado como representando uma infecção verdadeira. Em pacientes com
evidência clínica, laboratorial e radiológica de pneumonia, culturas em
crescimento de S. maltophilia de locais respiratórios devem ser interpretadas
como compativeis com infecção, mas na sua ausência, o crescimento de S.
maltophilia provavelmente represente colonização em vez de doença invasiva. Da
mesma forma, a interpretação de dados de cultura obtidos de locais não estéreis
(por exemplo, cateteres ou drenos) deve levar em conta a propensão do organismo
a colonizar material estranho sem causar infecção.
· Para a terapia empírica e dirigida de infecções
por S. maltophilia, sugere-se iniciar com sulfametoxazol-trimetoprim (TMP-SMX).
Para o tratamento empírico de pacientes gravemente doentes com infecções por S.
maltophilia, que apresentam uma condição imunocomprometida ou que apresentam
sintomas persistentes apesar do TMP-SMX, sugere-se a adição de um segundo
agente (como levofloxacina ou ceftazidima ) até que os resultados de
suscetibilidade estejam disponíveis. Se um paciente não puder usar o TMP-SMX
por causa de hipersensibilidade ou outra toxicidade esperada, sugere-se
levofloxacina ou ceftazidima para terapia empírica; sendo a
ticarcilina-clavulanato também uma alternativa aceitável para terapia dirigida
se o isolado for suscetível.
·
A duração da terapia depende do local da
infecção. 14 dias de terapia é apropriada para bacteremia e 7 dias de terapia é
geralmente apropriada para pneumonia hospitalar em um hospedeiro
imunocompetente. Certas infecções podem justificar intervenções adicionais,
como a remoção de dispositivos invasivos ou o desbridamento da ferida.
·
As medidas de controle e prevenção de infecção
são de extrema importância para minimizar a incidência de infecções por S.
maltophilia e para reduzir o surgimento de cepas resistentes. Essas medidas
incluem o uso criterioso de antibióticos, evitar o uso prolongado ou
desnecessário de dispositivos invasivos e a adesão às práticas de prevenção de
infecção, principalmente a higienização das mãos.
[1] Brooke
JS. Stenotrophomonas maltophilia: an emerging global opportunistic pathogen.
ClinMicrobiol Rev 2012; 25: 2–41.
[2]
Guitierrez Cristina, et. al. Fatal hemorrhagic pneumonia: Don’t
forgetStenotrophomonasmaltophilia. Respiratory Medicine Case Reports 19 (2016)
12e14. http://dx.doi.org/10.1016/j.rmcr.2016.06.003
[3]
Wei C, Ni W, Cai X et al. Evaluation of trimethoprim/sulfamethoxazole (SXT),
minocycline, tigecycline, moxifloxacin, and ceftazidime alone and in combinations
for SXT-susceptible and SXT-resistant Stenotrophomonas maltophilia by in vitro
time-kill experiments. PLoSOne 2016; 11: e0152132.
[4]
Cho SY, Lee DG, Choi SM et al. Stenotrophomonas maltophilia bloodstream infection
in patients with hematologic malignancies: a retrospective study and in vitro
activities of antimicrobial combinations. BMC Infect Dis 2015; 15: 69.
[5]
Poulos CD,Matsumura SO,Willey BMet al. In vitro activities of antimicrobial combinations
against Stenotrophomonas maltophilia. Antimicrob Agents Chemother 1995; 39:
2220–3.
[6]
Munoz JL, Garcia MI,Munoz S et al. Activity of trimethoprim/sulfamethoxazole plus
polymyxin B against multiresistant Stenotrophomonas maltophilia. Eur J
ClinMicrobiol Infect Dis 1996; 15: 879–82.
[7] Chung HS, Hong SG, Kim YR et al.
Antimicrobial susceptibility of Stenotrophomonas maltophilia isolates from
Korea, and the activity of antimicrobial combinations against the isolates. J
Korean Med Sci 2013; 28: 62–6.
[8]
Zelenitsky SA, Iacovides H, Ariano RE et al. Antibiotic combinations
significantly more active than monotherapy in an in vitro infection model of Stenotrophomonasmaltophilia.
DiagnMicrobiol Infect Dis 2005; 51: 39–43.
[9]
Hand E, Davis H, Kim T et al. Monotherapy with minocycline or trimethoprim/ sulfamethoxazole
for treatment of Stenotrophomonas maltophilia infections. J Antimicrob
Chemother 2016; 71: 1071–5.
[10]
Wang YL, ScipioneMR,Dubrovskaya Y et al.Monotherapywith fluoroquinolone or
trimethoprim/sulfamethoxazole for treatment of Stenotrophomonas maltophilia
infections. Antimicrob Agents Chemother 2014; 58: 176–82.
[11]
Cho SY, Kang CI, KimJ et al. Can levofloxacin be a useful alternative to trimethoprim/sulfamethoxazole
for treating Stenotrophomonas maltophiliabacteremia? Antimicrob Agents
Chemother 2014; 58: 581–3.
[12]
Muder RR,HarrisAP,Muller S et al. Bacteremia due to Stenotrophomonas (Xanthomonas)
maltophilia: a prospective multicenter study of 91 episodes. Clin Infect Dis
1996; 22: 508–12.
[13]
Megan D. Shah, et.al., Efficacy of combination therapy versus monotherapy in
the treatment of Stenotrophomonas maltophilia pneumonia. J Antimicrob Chemother.
Received 7 September 2018; returned 10 January 2019; revised 5 February 2019;
accepted 26 February 2019. doi:10.1093/jac/dkz116
[14]
Freitas FTM. Fatores de risco associados à aquisição de pneumonia por Stenotrophomonas
maltophilia na Unidade de Terapia Intensiva do Instituto de Infectologia Emílio
Ribas no período de março a novembro de 2007: investigação de um surto
[monografia]. São Paulo: Instituto de Infectologia Emílio Ribas; 2008
[1] https://www.uptodate.com/contents/stenotrophomonas-maltophilia?search=Stenotrophomonas%20maltophilia&source=search_result&selectedTitle=1~32&usage_type=default&display_rank=1

Nenhum comentário:
Postar um comentário